题目内容
 一定温度下,在一个10L密闭容器中只投反应物发生某可逆反应,其平衡常数表达式为K=
一定温度下,在一个10L密闭容器中只投反应物发生某可逆反应,其平衡常数表达式为K=| c(CO)?c(H2) |
| c(H2O) |
(1)该反应的化学方程式为
(2)能判断该反应一定达到平衡状态的是
A.υ正(H2O)=υ逆(H2)
B.容器中气体的平均相对分子质量不随时间改变
C.消耗nmolH2的同时消耗nmolCO
D.容器中物质的总物质的量不随时间改变
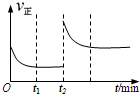
(3)该反应的υ正随时间变化的关系如图,在t2时改变了某种条件,改变的条件可能是
考点:化学平衡的影响因素,化学平衡状态的判断
专题:化学平衡专题
分析:(1)依据平衡常数表达式书写方法和元素守恒写出化学方程式,用生成物平衡浓度的幂次方乘积除以反应物平衡浓度幂次方乘积,平衡移动原理分析可知,温度升高,平衡常数中等,说明平衡正向进行为吸热反应;
(2)化学平衡的根本原因是正、逆反应速率相等,反应混合物中各组分的百分含量保持不变,然后根据具体的化学方程式,逐一判断.
(3)根据图象可知,t2时正反应速率立即增大,达到平衡时正反应速率大于原平衡状态时的反应速率;
(2)化学平衡的根本原因是正、逆反应速率相等,反应混合物中各组分的百分含量保持不变,然后根据具体的化学方程式,逐一判断.
(3)根据图象可知,t2时正反应速率立即增大,达到平衡时正反应速率大于原平衡状态时的反应速率;
解答:
解:(1)①根据平衡常数的定义,生成物浓度的幂之积与反应物浓度的幂之积之比为平衡常数,反应的方程式为C(s)+H2O(g)?CO(g)+H2 (g),
故答案为:C(s)+H2O(g)?CO(g)+H2 (g);
(2)A、υ正(H2O)=υ逆(H2)时,氢气正逆反应速率相同,反应达到平衡,故A正确;
B、反应前后气体的物质的量不相同,气体质量变化,容器中气体的平均相对分子质量不随时间变化即达到平衡,故B正确;
C、消耗n mol H2的同时消耗n mol CO,反应都代表逆反应,不能说明反应达到平衡状态,故C错误;
D、碳为固体,反应前后气体体积发生变化,容器中气体总物质的量不随时间变化,说明反应达到平衡状态,故D正确;
故答案为:ABD;
(3)由图象可以知道,在t2时正反应速率立即增大,且达到平衡时正反应速率大于原平衡状态时的反应速率,说明达到平衡时反应物的浓度大于原平衡的浓度,根据影响反应速率的因素分析,可以加入生成物H2O(g),正反应速率会立刻增大,达到新的平衡时H2O(g)的浓度比原平衡的浓度大,反应速率增大;反应是吸热反应,也可以升高温度,正逆反应速率都增大,且达到平衡时正逆反应速率都大于原平衡的速率,
故答案为:加入H2O(g);升高温度;
故答案为:C(s)+H2O(g)?CO(g)+H2 (g);
(2)A、υ正(H2O)=υ逆(H2)时,氢气正逆反应速率相同,反应达到平衡,故A正确;
B、反应前后气体的物质的量不相同,气体质量变化,容器中气体的平均相对分子质量不随时间变化即达到平衡,故B正确;
C、消耗n mol H2的同时消耗n mol CO,反应都代表逆反应,不能说明反应达到平衡状态,故C错误;
D、碳为固体,反应前后气体体积发生变化,容器中气体总物质的量不随时间变化,说明反应达到平衡状态,故D正确;
故答案为:ABD;
(3)由图象可以知道,在t2时正反应速率立即增大,且达到平衡时正反应速率大于原平衡状态时的反应速率,说明达到平衡时反应物的浓度大于原平衡的浓度,根据影响反应速率的因素分析,可以加入生成物H2O(g),正反应速率会立刻增大,达到新的平衡时H2O(g)的浓度比原平衡的浓度大,反应速率增大;反应是吸热反应,也可以升高温度,正逆反应速率都增大,且达到平衡时正逆反应速率都大于原平衡的速率,
故答案为:加入H2O(g);升高温度;
点评:本题考查了化学平衡影响因素分析,平衡常数计算,图象分析判断,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
下列关于常见有机物的说法中,正确的是( )
| A、汽油、苯、乙醇都属于烃类物质 |
| B、含5个碳原子的有机物,分子中最多可形成5个碳碳单键 |
| C、等物质的量的乙醇和乙酸完全燃烧时所需氧气的质量相等 |
| D、二氧化硫和乙烯都能使溴水褪色,二者反应原理相同 |
下列过程中所发生的化学反应属于酯化反应的是( )
| A、在浓硫酸、加热条件下,乙醇和乙酸反应 |
| B、乙醇使酸性高锰酸钾褪色 |
| C、在铁粉存在的条件下,苯与液溴反应 |
| D、甲烷与氯气在光照条件下反应 |