题目内容
在一定温度下,将2mol A和2mol B两种气体相混合后于容积为2L的某密闭容器中,发生如下反应3A(g)+B(g)?xC(g)+2D(g),2min末反应达到平衡状态,生成了0.8mol D,以C表示的反应速率为0.2mol/(L?min),请填写下列空白:
(1)x值等于 .
(2)A的转化率为 .
(3)如果增大反应体系的压强,则平衡体系中C的质量分数 (选填“增大”、“减小”或“不变”).
(4)如果上述反应在相同条件下从逆反应开始进行,开始加入C和D各
mol,要使平衡时各物质的质量分数与原平衡时完全相等,则还应加入 物质 mol.
(1)x值等于
(2)A的转化率为
(3)如果增大反应体系的压强,则平衡体系中C的质量分数
(4)如果上述反应在相同条件下从逆反应开始进行,开始加入C和D各
| 4 |
| 3 |
考点:化学平衡的计算
专题:化学平衡专题
分析:(1)C表示的反应速率为0.2mol/(L?min),平衡时C的浓度为0.4mol/L,则n(C)=0.4mol/L×2L=0.8mol,结合n(D)利用物质的量之比等于化学计量数之比计算x;
(2)根据平衡时n(D),由方程式可知参加反应的n(A)=
n(D),再根据转化率定义计算A的转化率;
(3)若反应前后气体的物质的量不变,增大压强,平衡不移动,平衡体系中C的质量分数不变;若反应前后气体的物质的量变化,增大压强平衡向气体物质的量减小的分析移动,气体的总质量不变,据此判断;
(4)由(1)可知反应前后气体的物质的量不变,恒温恒容下,按化学计量数转化到左边,满足n(A):n(B)=2mol:2mol=1:1即可,据此判断应加入的物质及该物质的量物质的量.
(2)根据平衡时n(D),由方程式可知参加反应的n(A)=
| 3 |
| 2 |
(3)若反应前后气体的物质的量不变,增大压强,平衡不移动,平衡体系中C的质量分数不变;若反应前后气体的物质的量变化,增大压强平衡向气体物质的量减小的分析移动,气体的总质量不变,据此判断;
(4)由(1)可知反应前后气体的物质的量不变,恒温恒容下,按化学计量数转化到左边,满足n(A):n(B)=2mol:2mol=1:1即可,据此判断应加入的物质及该物质的量物质的量.
解答:
解:(1)以C表示的反应速率为0.2mol/(L?min),平衡时C的浓度为0.4mol/L,则n(C)=0.4mol/L×2L=0.8mol,物质的量之比等于化学计量数之比,所以0.8mol:0.8mol=x:2,解得x=2,
故答案为:2;
(2)平衡时n(D)=0.8mol,由方程式可知参加反应的n(A)=
n(D)=
×0.8mol=1.2mol,故A的转化率为
×100%=60%,故答案为:60%;
(3)反应前后气体的物质的量不变,增大压强,平衡不移动,平衡体系中C的质量分数不变,
故答案为:不变;
(4)该反应前后气体的物质的量不变,恒温恒容下,按化学计量数转化到左边,满足n(A):n(B)=2mol:2mol=1:1即可,开始加入C和D各
mol,由化学方程式3A(g)+B(g)?2C(g)+2D(g)可知转化到左边,可以得到A为
mol×
=2mol,得到B为
mol×
=
mol,故还需要加入B,加入B的物质的量为2mol-
mol=
mol;
故答案为:B;
.
故答案为:2;
(2)平衡时n(D)=0.8mol,由方程式可知参加反应的n(A)=
| 3 |
| 2 |
| 3 |
| 2 |
| 1.2mol |
| 2mol |
(3)反应前后气体的物质的量不变,增大压强,平衡不移动,平衡体系中C的质量分数不变,
故答案为:不变;
(4)该反应前后气体的物质的量不变,恒温恒容下,按化学计量数转化到左边,满足n(A):n(B)=2mol:2mol=1:1即可,开始加入C和D各
| 4 |
| 3 |
| 4 |
| 2 |
| 3 |
| 2 |
| 4 |
| 3 |
| 1 |
| 2 |
| 2 |
| 3 |
| 2 |
| 3 |
| 4 |
| 3 |
故答案为:B;
| 4 |
| 3 |
点评:本题考查化学平衡的有关计算、影响化学平衡的因素、等效平衡等,难度中等,注意等效平衡规律的掌握.

练习册系列答案
 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
下列对应的反应方程式正确的是( )
| A、苯酚钠溶液中通入少量CO2 2C6H5ONa+CO2+H2O→2C6H5OH+Na2CO3 | ||
B、乙酸乙酯在酸性条件下水解 CH3COOCH2CH3+H218O
| ||
C、溴乙烷的消去反应 C2H5Br+NaOH
| ||
D、乙醛和银氨溶液反应 CH3CHO+2Ag(NH3)2OH
|
四种基本类型反应与氧化还原反应的关系可用下列哪个图表示( )
A、 |
B、 |
C、 |
D、 |
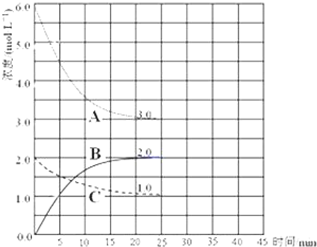 目前工业合成氨的原理是:N2(g)+3H2(g)?2NH3(g)△H=-93.0kJ/mol;
目前工业合成氨的原理是:N2(g)+3H2(g)?2NH3(g)△H=-93.0kJ/mol;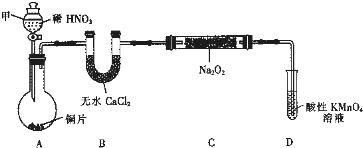
 一定温度下,在一个10L密闭容器中只投反应物发生某可逆反应,其平衡常数表达式为K=
一定温度下,在一个10L密闭容器中只投反应物发生某可逆反应,其平衡常数表达式为K= 有几种元素的微粒的最外电子层结构如图所示,其中:
有几种元素的微粒的最外电子层结构如图所示,其中: