题目内容
胃液中含有盐酸,胃酸过多的人常有胃疼的感觉,易吐酸水,服用适量的小苏打(NaHCO3),能治疗胃酸过多,反应的离子方程式是 .如果某病人患有胃溃疡,此时最好服用胃舒平(主要成分是氢氧化铝),反应的离子方程式是 .
考点:镁、铝的重要化合物,钠的重要化合物
专题:几种重要的金属及其化合物
分析:小苏打(NaHCO3)和盐酸反应生成氯化钠水和二氧化碳;氢氧化铝和盐酸反应生成三氯化铝和水.
解答:
解:小苏打(NaHCO3)和盐酸反应生成氯化钠水和二氧化碳:NaHCO3+HCl=NaCl+H2O+CO2↑,离子方程式为:HCO3-+2H+═CO2↑+H2O;
氢氧化铝和盐酸反应生成三氯化铝和水:Al(OH)3+HCl=AlCl3+H2O,离子方程式为:3H++Al(OH)3=Al3++3H2O;
故答案为:HCO3-+2H+═CO2↑+H2O;3H++Al(OH)3=Al3++3H2O.
氢氧化铝和盐酸反应生成三氯化铝和水:Al(OH)3+HCl=AlCl3+H2O,离子方程式为:3H++Al(OH)3=Al3++3H2O;
故答案为:HCO3-+2H+═CO2↑+H2O;3H++Al(OH)3=Al3++3H2O.
点评:本题考查碳酸氢钠、氢氧化铝和酸反应的离子方程式,题目比较简单.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列各组物质中,所含分子数相同的是( )
| A、9 g H2O和0.5molBr2 |
| B、5.6LN2(标准状态)和11 g CO2 |
| C、10 g H2和10 g O2 |
| D、224mlH2(标准状态) 和0.1molN2 |
1.52g铜镁合金完全溶解于50mL密度为1.40g/cm3、质量分数为63%的浓硝酸中,得到NO2和N2O4 的混合气体1120mL (标准状况),向反应后的溶液中加入1.0mol?L-1NaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀.下列说法不正确的是( )
| A、该合金中铜与镁的物质的量之比是2:1 |
| B、该浓硝酸中HNO3的物质的量浓度是14.0 mol?L-1 |
| C、NO2和N2O4 的混合气体中,NO2和N2O4 的物质的量之比是1:4 |
| D、得到2.54 g沉淀时,加入NaOH溶液的体积是640 mL |
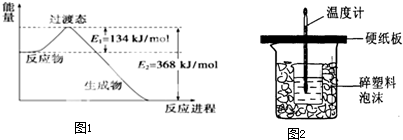
下列依据热化学方程式得出的结论正确的是( )
| A、已知C(石墨,s)═C(金刚石,s);△H>0;则金刚石比石墨稳定. | ||
B、已知C(s)+02(g)═CO2(g);△H1 C(s)+
| ||
| C、已知2H2(g)+O2(g)═2H2O(g);△H=-483.6kJ/mol 则氢的燃烧热为241.8kJ/mol | ||
| D、已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.3kJ/mol则含20gNaOH的稀溶液与稀盐酸完全中和,放出28.65kJ的热量 |
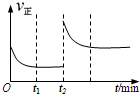 一定温度下,在一个10L密闭容器中只投反应物发生某可逆反应,其平衡常数表达式为K=
一定温度下,在一个10L密闭容器中只投反应物发生某可逆反应,其平衡常数表达式为K=