题目内容
19.有A、B、C三种可溶性盐,阴、阳离子各不相同,其阴离子的摩尔质量按A、B、C的顺序依次增大.将等物质的量的A、B、C溶于水,所得溶液中只含有Fe3+、NH4+、SO42-、NO3-、Cl-五种离子,同时生成一种白色沉淀.请回答下列问题:(1)经检验,三种盐中还含有下列选项中的一种离子,该离子是B.
A.Na+ B.Ba2+ C.Mg2+D.Cu2+
(2)写出C的化学式:CFe2(SO4)3.
(3)若将A、B、C三种盐按一定比例溶于水,所得溶液中只含有Fe3+、Cl-、NO3-、NH4+四种离子且物质的量之比依次为1:1:3:1(不考虑水电离的影响).则A、B、C三种盐的物质的量之比为2:3:1.若向B溶液中通入少量SO2气体,有沉淀和无色气体产生,该沉淀为硫酸钡(或BaSO4).
分析 等物质的量的A、B、C溶于水,所得溶液中只含有Fe3+、NH4+、SO42-、NO3-、Cl-五种离子,同时生成一种白色沉淀,A、B、C三种可溶性盐,阴、阳离子各不相同,其阴离子的摩尔质量依次增大,则A为盐酸盐,B为硝酸盐,C为硫酸盐;等物质的量混合,生成沉淀可能为硫酸钡,则A为NH4Cl,B为Ba(NO3)2,C为Fe2(SO4)3,以此来解答.
解答 解:等物质的量的A、B、C溶于水,所得溶液中只含有Fe3+、NH4+、SO42-、NO3-、Cl-五种离子,同时生成一种白色沉淀,A、B、C三种可溶性盐,阴、阳离子各不相同,其阴离子的摩尔质量依次增大,则A为盐酸盐,B为硝酸盐,C为硫酸盐;等物质的量混合,生成沉淀可能为硫酸钡,则A为NH4Cl,B为Ba(NO3)2,C为Fe2(SO4)3,
(1)白色沉淀为硫酸钡,则三种盐中还含有Ba2+,故答案为:B;
(2)由上述分析可知,C为Fe2(SO4)3,故答案为:Fe2(SO4)3;
(3)Fe3+、Cl-、NO3-、NH4+四种离子且物质的量之比依次为1:1:3:1,设NH4Cl为1mol,则Ba(NO3)2为1.5mol,Fe2(SO4)3为0.5mol,A、B、C三种正盐的物质的量之比为2:3:1,若向B溶液中通入少量SO2气体,有沉淀和无色气体产生,硝酸钡与二氧化硫发生氧化还原反应生成BaSO4沉淀和NO气体,
故答案为:2:3:1;硫酸钡(或BaSO4).
点评 本题考查无机物的推断,为高频考点,把握等物质的量混合时硫酸根离子剩余推断C为硫酸铁为解答的关键,侧重分析与推断能力的考查,注意元素化合物知识及氧化还原反应的应用,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
10.能正确表示下列反应的离子方程式为( )
| A. | NH4HCO3溶于过量的浓KOH溶液中:NH4++HCO3-+2OH-═CO32-+NH3↑+2H2O | |
| B. | 碳酸钠溶液中加入澄清石灰水:Ca(OH)2+CO32-═CaCO3↓+2OH- | |
| C. | 稀硫酸中加入铁粉:2Fe+6H+═2Fe3++3H2↑ | |
| D. | 醋酸除去水垢:2H++CaCO3═Ca2++CO2↑+H2O |
7.某实验小组以粗镍(含少量Fe和Cr杂质)为原料制备Ni(NH3)6Cl2,并测定相关组分的含量.制备流程示意图如图.
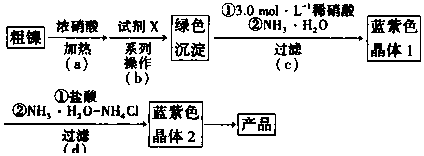
已知:①部分离子生成氢氧化物沉淀的pH(开始沉淀的pH按离子浓度为0.1mol•L-1计算)如表所示.
②Ni(OH)2为绿色难溶物.Ni(NH3)6(NO3)2、Ni(NH3)6Cl2均为可溶于水的蓝紫色晶体,水溶液均显碱性.
回答下列问题:
(1)实验需要配制3.0mol•L-1稀硝酸250mL.需要的玻璃仪器有烧杯、量筒、玻璃棒,胶头滴管和250mL容量瓶.
(2)步骤(a)中Ni和浓硝酸反应的化学方程式为Ni+4(浓)HNO3$\frac{\underline{\;\;△\;\;}}{\;}$Ni(NO3)2+2NO2↑+2H2O.
(3)步骤(b)首先加入试剂x调节溶液的pH约为6,过滤后再继续加入X调节pH以得到绿色沉淀.
①调节pH约为6的原因是使Cr3+、Fe3+完全沉淀,而Ni2+未开始沉淀
②试剂X可以是C(填标号).
A.H2SO4 B.Ni(OH)2 C.NaOH D.Fe2O3 E.NiO
(4)步骤(c)和(d)中的反应都需要在冰水浴环境下进行,其作用除了可以减少氨水的挥发.还有降低温度以降低产物的溶解度而析出
(5)NH3含量的测定.[已知:Ni(NH3)6Cl2+6HCl=NiCl2+6NH4Cl]
i.用电子天平称量mg产品于锥形瓶中,用25mL水溶解后加入5mL的6mol•L-1盐酸,以甲基橙作指示剂,滴定至终点消耗0.500 0mol•L-1 NaOH标准溶液V1mL.
ii.空白试验:不加入样品重复实验i.消耗NaOH标准溶液V2 mL.
①NH3的质量分数为$\frac{(V{\;}_{2}-V{\;}_{1})×10{\;}^{-3}×8.5}{m}$×100%.
②在上述方案的基础上,下列措施中能进一步提高测定准确度的有AD(填标号).
A.适当提高称量产品的质量 B.用H2SO4溶液替代盐酸C.用酚酞替代甲基橙 D.进行平行试验.

已知:①部分离子生成氢氧化物沉淀的pH(开始沉淀的pH按离子浓度为0.1mol•L-1计算)如表所示.
| Fe3+ | Cr3+ | Ni2+ | |
| 开始沉淀pH | 1.5 | 4.3 | 6.9 |
| 完全沉淀pH | 2.8 | 5.6 | 8.9 |
回答下列问题:
(1)实验需要配制3.0mol•L-1稀硝酸250mL.需要的玻璃仪器有烧杯、量筒、玻璃棒,胶头滴管和250mL容量瓶.
(2)步骤(a)中Ni和浓硝酸反应的化学方程式为Ni+4(浓)HNO3$\frac{\underline{\;\;△\;\;}}{\;}$Ni(NO3)2+2NO2↑+2H2O.
(3)步骤(b)首先加入试剂x调节溶液的pH约为6,过滤后再继续加入X调节pH以得到绿色沉淀.
①调节pH约为6的原因是使Cr3+、Fe3+完全沉淀,而Ni2+未开始沉淀
②试剂X可以是C(填标号).
A.H2SO4 B.Ni(OH)2 C.NaOH D.Fe2O3 E.NiO
(4)步骤(c)和(d)中的反应都需要在冰水浴环境下进行,其作用除了可以减少氨水的挥发.还有降低温度以降低产物的溶解度而析出
(5)NH3含量的测定.[已知:Ni(NH3)6Cl2+6HCl=NiCl2+6NH4Cl]
i.用电子天平称量mg产品于锥形瓶中,用25mL水溶解后加入5mL的6mol•L-1盐酸,以甲基橙作指示剂,滴定至终点消耗0.500 0mol•L-1 NaOH标准溶液V1mL.
ii.空白试验:不加入样品重复实验i.消耗NaOH标准溶液V2 mL.
①NH3的质量分数为$\frac{(V{\;}_{2}-V{\;}_{1})×10{\;}^{-3}×8.5}{m}$×100%.
②在上述方案的基础上,下列措施中能进一步提高测定准确度的有AD(填标号).
A.适当提高称量产品的质量 B.用H2SO4溶液替代盐酸C.用酚酞替代甲基橙 D.进行平行试验.
4. (1)根据VSEPR模型判断,下列微粒中所有原子都在同一平面上的一组是B.
(1)根据VSEPR模型判断,下列微粒中所有原子都在同一平面上的一组是B.
A、SO32-和NO2-B、NO3-和SO3
C、H3O+和ClO3-D、PO43-和SO32-
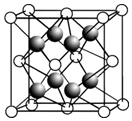
(2)CaF2的晶胞如图所示.
①下列有关CaF2的表达正确的是bd.
a.Ca2+与F-间仅存在静电吸引作用
b.F-的离子半径小于Cl-,则CaF2的熔点高于CaCl2
c.阴、阳离子比为2:1的离子化合物,均与CaF2晶体构型相同
d.CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电
②CaF2难溶于水,但可溶于含Al3+的溶液中,原因是3CaF2+Al3+=[AlF6]3-+3Ca2+ (用离子方程式表示,已知[AlF6]3-在溶液中可稳定存在).
③晶胞中F-的配位数是4,与一个Ca2+等距离且最近的Ca2+有12个.
(3)铜、锌两种元素的第一电离能、第二电离能如表所示
④写出Cu原子核外电子排布式[Ar]3d104s1;
⑤铜的第一电离能(I1)小于锌的第一电离能,而铜的第二电离能(I2)却大于锌的第二电离能,其主要原因是Cu原子失去一个电子后,核外电子排布为[Ar]3d10,而锌为[Ar]3d104s1,根据洪特规则,铜达到了较稳定状态,所以Cu的第二电离能相对较大.
 (1)根据VSEPR模型判断,下列微粒中所有原子都在同一平面上的一组是B.
(1)根据VSEPR模型判断,下列微粒中所有原子都在同一平面上的一组是B.A、SO32-和NO2-B、NO3-和SO3
C、H3O+和ClO3-D、PO43-和SO32-
(2)CaF2的晶胞如图所示.
①下列有关CaF2的表达正确的是bd.
a.Ca2+与F-间仅存在静电吸引作用
b.F-的离子半径小于Cl-,则CaF2的熔点高于CaCl2
c.阴、阳离子比为2:1的离子化合物,均与CaF2晶体构型相同
d.CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电
②CaF2难溶于水,但可溶于含Al3+的溶液中,原因是3CaF2+Al3+=[AlF6]3-+3Ca2+ (用离子方程式表示,已知[AlF6]3-在溶液中可稳定存在).
③晶胞中F-的配位数是4,与一个Ca2+等距离且最近的Ca2+有12个.
(3)铜、锌两种元素的第一电离能、第二电离能如表所示
| 电离能/kJ•mol-1 | I1 | I2 |
| 铜 | 746 | 1958 |
| 锌 | 906 | 1733 |
⑤铜的第一电离能(I1)小于锌的第一电离能,而铜的第二电离能(I2)却大于锌的第二电离能,其主要原因是Cu原子失去一个电子后,核外电子排布为[Ar]3d10,而锌为[Ar]3d104s1,根据洪特规则,铜达到了较稳定状态,所以Cu的第二电离能相对较大.
11. 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g)?CH3OH(g)
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g)?CH3OH(g)
(1)表所列数据是该反应在不同温度下的化学平衡常数(K)
①该反应的平衡常数表达式K=$\frac{c(C{H}_{3}OH)}{c(CO){c}^{2}({H}_{2})}$,△H<0(填“>”、“<”或“=”).
②300℃下,将2mol CO、6mol H2和4molCH3OH充入2L的密闭容器中,判断反应正向(填“正向”或“逆向”)进行.
③要提高CO的转化率,可以采取的措施是df(填序号).
a.升温 b.加入催化剂 c.增加CO的浓度 d.加入H2加压 e.加入惰性气体加压 f.分离出甲醇
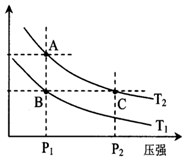
(2)如图表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A<C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A=C,由状态B到状态A,可采用升温的方法(填“升温”或“降温”).
(3)已知在常温常压下:化学反应①②③④的平衡常数分别为K1,K2,K3,K4
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g) K1
②2CO(g)+O2(g)═2CO2(g) K2
③H2O(g)═H2O(l) K3
④CH3OH(l)+O2(g)═CO(g)+2H2O(l) K4
则K4=$\frac{{{K}_{1}}^{\frac{1}{2}}{{K}_{3}}^{2}}{{K}_{2}\frac{1}{2}}$(用含有K1,K2,K3的代数式表达).
 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g)?CH3OH(g)
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g)?CH3OH(g)(1)表所列数据是该反应在不同温度下的化学平衡常数(K)
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
②300℃下,将2mol CO、6mol H2和4molCH3OH充入2L的密闭容器中,判断反应正向(填“正向”或“逆向”)进行.
③要提高CO的转化率,可以采取的措施是df(填序号).
a.升温 b.加入催化剂 c.增加CO的浓度 d.加入H2加压 e.加入惰性气体加压 f.分离出甲醇
(2)如图表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A<C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A=C,由状态B到状态A,可采用升温的方法(填“升温”或“降温”).
(3)已知在常温常压下:化学反应①②③④的平衡常数分别为K1,K2,K3,K4
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g) K1
②2CO(g)+O2(g)═2CO2(g) K2
③H2O(g)═H2O(l) K3
④CH3OH(l)+O2(g)═CO(g)+2H2O(l) K4
则K4=$\frac{{{K}_{1}}^{\frac{1}{2}}{{K}_{3}}^{2}}{{K}_{2}\frac{1}{2}}$(用含有K1,K2,K3的代数式表达).
1.某学生用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为:
A、移取20.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
B、用标准溶液润洗滴定管2-3次
C、把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
D、取标准KOH溶液注入碱式滴定管至0刻度以上2-3cm
E、调节液面至0或0刻度以下,记下读数
F、把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度
(1)正确操作的顺序是(用序号字母填写)BDCEAF.
(2)上述B操作的目的是防止将标准液稀释.
(3)实验中用左手控制碱式滴定管橡皮管玻璃珠处(填仪器及部位),眼睛注视锥形瓶中溶液的颜色变化,直至滴定终点.判断到达终点的现象是锥形瓶中溶液的颜色由无色变浅红且保持30秒内不褪色.
(4)某学生根据三次实验分别记录有关数据如下表:
列式计算该盐酸溶液的物质的量浓度:c(HCl)=0.1135 mol/L.
(5)下列操作对滴定结果的影响偏低的是①⑤⑥.
①酸式滴定管未用待测液润洗 ②碱式滴定管未用标准液润洗
③锥形瓶未干燥 ④滴定前碱式滴定管尖嘴部分有气泡,滴定过程中气泡消失
⑤滴定中将锥形瓶内液体摇出少量于瓶外 ⑥滴定结束后俯视观察滴定管中液面刻度.
A、移取20.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
B、用标准溶液润洗滴定管2-3次
C、把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
D、取标准KOH溶液注入碱式滴定管至0刻度以上2-3cm
E、调节液面至0或0刻度以下,记下读数
F、把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度
(1)正确操作的顺序是(用序号字母填写)BDCEAF.
(2)上述B操作的目的是防止将标准液稀释.
(3)实验中用左手控制碱式滴定管橡皮管玻璃珠处(填仪器及部位),眼睛注视锥形瓶中溶液的颜色变化,直至滴定终点.判断到达终点的现象是锥形瓶中溶液的颜色由无色变浅红且保持30秒内不褪色.
(4)某学生根据三次实验分别记录有关数据如下表:
| 实验 编号 | KOH溶液的 浓度/mol•L-1 | 滴定完成时,KOH溶液滴入的体积/mL | 待测盐的体积/mL酸 |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |
(5)下列操作对滴定结果的影响偏低的是①⑤⑥.
①酸式滴定管未用待测液润洗 ②碱式滴定管未用标准液润洗
③锥形瓶未干燥 ④滴定前碱式滴定管尖嘴部分有气泡,滴定过程中气泡消失
⑤滴定中将锥形瓶内液体摇出少量于瓶外 ⑥滴定结束后俯视观察滴定管中液面刻度.
 .
. 甲醇是一种可再生的清洁能源,一定条件下用CO和H2合成CH3OH:CO(g)+2H2 (g)?CH3OH(g)△H=a kJ•mol-1.向体积为2L的密闭容器中充入2mol CO和4mol H2,测得不同温度下容器内气体总物质的量随时间(min)的变化关系如图中Ⅰ、Ⅱ、Ⅲ曲线所示:
甲醇是一种可再生的清洁能源,一定条件下用CO和H2合成CH3OH:CO(g)+2H2 (g)?CH3OH(g)△H=a kJ•mol-1.向体积为2L的密闭容器中充入2mol CO和4mol H2,测得不同温度下容器内气体总物质的量随时间(min)的变化关系如图中Ⅰ、Ⅱ、Ⅲ曲线所示: