题目内容
16.实验室需要450mL0.2mol•L-1的硫酸,现用质量分数为98%、密度为1.84g•cm-3的浓硫酸来配制.请回答下列问题:(1)所需的仪器除了玻璃棒、烧杯、量筒,还可能用到的玻璃仪器是:500mL容量瓶、胶头滴管.
(2)配制溶液时,一般可以分为以下几个步骤:
①量取 ②计算 ③溶解 ④倒转摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却,其正确的操作顺序为②①③⑧⑤⑥⑦④.
(3)经计算,需浓硫酸的体积为5.4;
(4)在容量瓶的使用方法中,下列操作不正确的是(填编号)BCD.
A.往容量瓶中转移溶液时应用玻璃棒引流
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近标线2~3cm处,用滴管加蒸馏水到标线
D.配制溶液时,如果试样是液体,用量筒量取试样后,直接沿玻璃棒引流至容量瓶中,缓慢加入蒸馏水到标线
E.盖好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶反复倒转多次
(5)用浓硫酸配制稀H2SO4溶液时,下列操作导致结果偏高的是BC
A.量取浓硫酸时动作缓慢 B.量取时仰视量筒刻度线
C.洗涤量筒残余H2SO4 也转入稀释烧杯里 D.未洗涤烧杯和玻璃棒.
分析 (1)依据用浓溶液配制一定物质的量浓度溶液的一般步骤选择需要仪器;
(2)用浓溶液配制一定物质的量浓度溶液的一般步骤:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶等,据此排序;
(3)依据C=$\frac{1000ρω}{M}$计算浓硫酸的物质的浓度,根据依据溶液稀释过程中溶质的物质的量不变计算需要浓硫酸的体积;
(4)容量瓶是用来配制一定体积一定物质量浓度溶液的专用仪器,不能用来盛放过冷或者过热的液体,不能用来溶解固体或者稀释溶液,据此解答;
(5)分析操作对溶质物质的量、溶液体积的影响,根据c=$\frac{n}{V}$判断对所配溶液浓度影响.
解答 解:(1)用浓溶液配制一定物质的量浓度溶液的一般步骤:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶等,用到的仪器:量筒、胶头滴管、玻璃棒、烧杯、容量瓶,配制450mL0.2mol•L-1的硫酸,需要500mL容量瓶,所以还缺少的仪器:500mL容量瓶、胶头滴管;
故答案为:500mL容量瓶、胶头滴管;
(2)用浓溶液配制一定物质的量浓度溶液的一般步骤:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶等,所以正确的顺序为:②①③⑧⑤⑥⑦④;
故答案为:②①③⑧⑤⑥⑦④;
(3)质量分数为98%、密度为1.84g•cm-3的浓硫酸,C=$\frac{1000×1.84×98%}{98}$=18.4mol/L,设需要浓硫酸体积为V,则依据溶液稀释过程中溶质的物质的量不变得:V×18.4mol/L=500mL×0.2mol/L,解得V=5.4mL;
故答案为:5.4;
(4)A.容量瓶瓶颈较细,移液应用玻璃棒引流,故A正确;
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗,导致溶质的物质的量偏大,溶液浓度偏高,故B错误;
C.容量瓶不能用于溶解固体,应在烧杯中溶解,再移液到容量瓶,故C错误;
D.容量瓶不能用于稀释浓溶液,应在烧杯中稀释,再移液到容量瓶,故D错误;
E.摇匀的正确操作为:盖好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶反复倒转多次,故E正确;
故选:BCD;
(5)A.量取浓硫酸时动作缓慢,导致浓硫酸吸水,浓度降低,量取的浓硫酸中含有溶质的物质的量偏小,溶液浓度偏低,故A不选;
B.量取时仰视量筒刻度线,导致量取的浓硫酸体积偏大,含有溶质的物质的量偏大,溶液浓度偏高,故B选;
C.洗涤量筒残余H2SO4 也转入稀释烧杯里,导致量取的浓硫酸体积偏大,含有溶质的物质的量偏大,溶液浓度偏高,故C选;
D.未洗涤烧杯和玻璃棒,导致溶质的物质的量偏小,溶液浓度偏低,故D不选;
故选BC.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理及操作步骤是解题关键,注意容量瓶规格选择,注意误差分析的方法,题目难度不大.

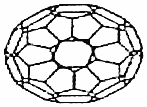
| A. | C60的摩尔质量是720 g•moL-1 | |
| B. | 1 mol C60完全燃烧生成22.4 L CO2 | |
| C. | C60属于有机化合物 | |
| D. | C60的结构与金刚石一样 |
| A. | 氯水、盐酸、火碱、硫酸钡 | B. | 水银、硫酸、烧碱、硫酸氢钠 | ||
| C. | 铜、醋酸、石灰石、氯化铜 | D. | 臭氧、硝酸、纯碱、胆矾 |
| A. | X是负极 | B. | Y是正极 | C. | Y极发生还原反应 | D. | Y极发生氧化反应 |
| A. | FeCl3 | B. | MgCl2 | C. | AlCl3 | D. | ZnCl2 |
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| NO的物质的量(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)用O2表示从0~2 s内该反应的平均速率v(O2)=0.00125mol/(L•s).
(3)能说明该反应已达到平衡状态的是bc.
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内气体密度保持不变
Ⅱ、下表中的数据是破坏1mol物质中的化学键所消耗的能量:
| 物质 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
| 能量(kJ) | 243 | 193 | 151 | 431 | 366 | 298 | 436 |
(4)下列物质本身具有的能量最低的是A.
A.H2 B.Cl2 C.Br2 D.I2
(5)下列氢化物中最稳定的是A.
A.HCl B.HBr C.HI
(6)X2+H2=2HX(X代表Cl、Br、I)的反应是吸热反应还是放热反应?放热反应.
 配制100mL 1.0mol?L-1的氯化钠溶液过程中,
配制100mL 1.0mol?L-1的氯化钠溶液过程中,