题目内容
11.燃料电池是一种新型电池,它利用燃料在反应过程中把化学能直接转化为电能.氢氧燃料电池的基本反应如下:X极,$\frac{1}{2}$O2(g)+H2O(l)+2e-═2OH-;Y极,H2(g)+2OH--2e-═2H2O(l).下列判断中,正确的是( )| A. | X是负极 | B. | Y是正极 | C. | Y极发生还原反应 | D. | Y极发生氧化反应 |
分析 原电池中,负极失电子元素化合价升高,发生氧化反应;正极得电子元素化合价降低,发生还原反应.
解答 解:X极:$\frac{1}{2}$O2(g)+H2O(l)+2e-═2OH-,该反应中O2得电子被还原,发生还原反应,应为原电池的正极反应,
Y极:H2(g)+2OH--2e-,═2H2O(l),该反应中H2失电子被氧化,发生氧化反应,应为原电池的负极反应,
故选D.
点评 本题考查电极反应的判断,题目难度不大,解答本题可从化合价的变化的角度入手,把握电极反应.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
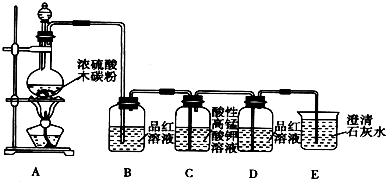
1.某化学兴趣小组欲探究浓硫酸的性质,请帮助他们完成相关实验报告:
(1)浓硫酸与木炭粉在加热条件下的化学方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O.
(2)已知KMnO4酸性溶液可以吸收SO2,试用图中各装置设计一个实验,验证上述反应所产生的各种产物.这些装置的连接顺序(按产物气流从左到右的方向)是(填装置的编号):④→②→①→③.
(3)实验时可观察到装置①中A瓶的溶液褪色,C瓶的溶液不褪色.A瓶溶液的作用是:验证产物气流中是否有SO2,B瓶溶液的作用是将SO2全部氧化吸收,C瓶溶液的作用是确证产物中SO2已被B瓶溶液全部氧化.
(4)装置②中所加的固体药品是无水CuSO4(或变色硅胶),可确证的产物是:水蒸气.确定装置②在整套装置中位置的理由是由于产物气流通过①③时会带出水蒸气,所以②必须在①③之前.
(5)装置③中所盛溶液是澄清石灰水,可验证的产物是CO2 .
(1)浓硫酸与木炭粉在加热条件下的化学方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O.
(2)已知KMnO4酸性溶液可以吸收SO2,试用图中各装置设计一个实验,验证上述反应所产生的各种产物.这些装置的连接顺序(按产物气流从左到右的方向)是(填装置的编号):④→②→①→③.
| 编号 | ① | ② | ③ | ④ |
| 装置 | 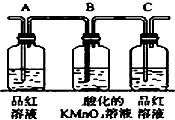 | 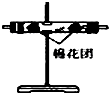 |  | 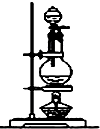 |
(4)装置②中所加的固体药品是无水CuSO4(或变色硅胶),可确证的产物是:水蒸气.确定装置②在整套装置中位置的理由是由于产物气流通过①③时会带出水蒸气,所以②必须在①③之前.
(5)装置③中所盛溶液是澄清石灰水,可验证的产物是CO2 .
19.下列说法中有明显错误的是( )
| A. | 活化分子之间发生的碰撞一定为有效碰撞 | |
| B. | 升高温度,一般可使活化分子的百分数增大,因而反应速率增大 | |
| C. | 对有气体参加的化学反应增大压强体系体积减小,可使单位体积内活化分子数增加,因而反应速率增大 | |
| D. | 加入适宜的催化剂,可使活化分子的百分数大大增加,从而成千上万倍地增大化学反应的速率 |
6.下列离子方程式正确的是( )
| A. | 氧化铜与硫酸溶液反应:Cu2++2H+═Cu2++H2O | |
| B. | 碳酸钠溶液与盐酸反应:Na2CO3+2H+═2Na++H2O+CO2↑ | |
| C. | 少量CO2通入澄清石灰水中:CO2+Ca2++2OH-═CaCO3↓+H2O | |
| D. | 钠投入到水中:Na+H2O═Na++OH-+H2↑ |
20.如图装置中,若关闭活塞,则品红试液无变化,石蕊试液变红,澄清石灰水变浑浊;若打开活塞,则品红试液褪色,石蕊试液变红,澄清石灰水变浑浊.据此判断气体和广口瓶中盛放的物质是( )
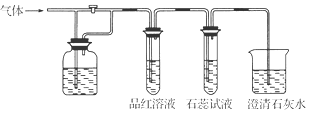

| A. | H2S和浓H2SO4 | B. | SO2和NaHCO3溶液 | C. | Cl2和NaHCO3溶液 | D. | Cl2和氯水 |
 已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数与未成对电子数的比值为3:2.同时含有A、B、D三种元素的化合物M是一种居室污染气体,其分子中所有的原子共平面.A、B两种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数与未成对电子数的比值为3:2.同时含有A、B、D三种元素的化合物M是一种居室污染气体,其分子中所有的原子共平面.A、B两种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.