题目内容
5.根据方程式KClO3+6HCl=KCl+3Cl2↑+2H2O 回答下列问题1)氧化剂与还原剂的物质的量之比是:1:5
2)盐酸体现出的性质有:酸性和还原性
3)用双线桥表示出电子转移的方向和数目:KClO3+6HCl=KCl+3Cl2↑+2H2O
4)当被氧化的HCl为73克时,转移的电子的数目为1.204×1024(填具体数字)
分析 反应中只有Cl元素化合价发生变化,KClO3中氯元素的化合价由+5价变为0价,HCl中Cl元素化合价由-1价升高到0价,当有3mol Cl2生成时,转移5mol电子,以此解答该题.
解答 解:1)在KClO3+6HCl═KCl+3Cl2↑+3H2O反应中,1KClO3中氯元素的化合价由+5价变为0价,所以1KClO3是氧化剂,5HCl中Cl元素化合价由-1价升高到0价,所以5HCl是还原剂,则氧化剂与还原剂的物质的量之比是1:5;故答案为:1:5;
2)在KClO3+6HCl═KCl+3Cl2↑+3H2O反应中,6HCl参与反应,其中5HCl中Cl元素化合价由-1价升高到0价,1HCl化合价不变,所以盐酸体现出的性质有酸性和还原性,故答案为:酸性和还原性;
3)反应中只有Cl元素化合价发生变化,Cl元素化合价分别由+5价、-1价变化为0价,当有3mol Cl2生成时,转移5mol电子,则电子转移的方向和数目为 ,
,
故答案为: ;
;
4)当被氧化的HCl为73克时即$\frac{73g}{36.5g/mol}$=2mol,又HCl中Cl元素化合价由-1价升高到0价被氧化,所以转移2mol电子,数目为1.204×1024,故答案为:1.204×1024.
点评 本题考查氧化还原反应,为高频考点,根据反应中元素化合价变化为解答的关键,侧重基本概念及转移电子的考查,题目难度不大.

练习册系列答案
相关题目
13.在一密闭容器中充入一定量的N2和H2,经测定反应开始后3秒内,H2的平均反应速率为0.3mol/(L•s),则3秒末NH3的浓度为( )
| A. | 0.45mol/L | B. | 0.5mol/L | C. | 0.6mol/L | D. | 0.55mol/L |
20.如图装置中,若关闭活塞,则品红试液无变化,石蕊试液变红,澄清石灰水变浑浊;若打开活塞,则品红试液褪色,石蕊试液变红,澄清石灰水变浑浊.据此判断气体和广口瓶中盛放的物质是( )
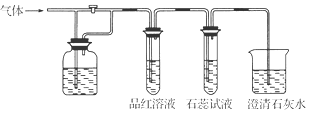

| A. | H2S和浓H2SO4 | B. | SO2和NaHCO3溶液 | C. | Cl2和NaHCO3溶液 | D. | Cl2和氯水 |
10.下列事实,不能用勒夏特列原理解释的是( )
| A. | 硫酸工业中,增大O2的浓度有利于提高SO2的转化率 | |
| B. | 开启啤酒瓶后,瓶中立刻泛起大量泡 | |
| C. | 对2HI(g)?H2(g)+I2(g)平衡体系增加压强使颜色变深 | |
| D. | 滴有酚酞的氨水溶液,适当加热溶液(氨气不挥发)后颜色变深 |
17.CO2和H2组成的混合气体在同温同压下与氮气的密度相同.则该混合气体中CO2与H2 的体积比为( )
| A. | 13:8 | B. | 8:13 | C. | 16:9 | D. | 9:16 |
9.可逆反应aA(g)+bB(g)?cC(g)+dD(g)△H=Q,同时符合下列两图中各曲线的规律是( )
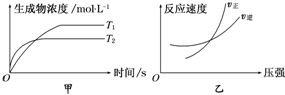

| A. | a+b>c+d T1>T2△H>0 | B. | a+b>c+d T1<T2 △H<0 | ||
| C. | a+b<c+d T1>T2△H>0 | D. | a+b>c+d T1>T2△H<0 |