题目内容
19.铁、铜单质及其化合物应用范围很广. 如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等.(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式2Fe3++Cu=2Fe2++Cu2+.
(2)腐蚀铜板后的混合溶液中,为制取纯净的CuCl2,按如图步骤进行提纯:
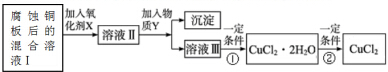
腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol•L-1,已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH,见下表:
| Fe3+ | Fe2+ | Cu2+ | |
| 氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 9.0 | 6.7 |
请回答下列问题:
①加入氧化剂的目的是将Fe2+氧化成Fe3+,便于生成Fe(OH)3沉淀而与Cu2+分离.
②最适合作氧化剂X的是C.
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
③加入Y物质,调至pH=4,加入的物质Y可能是CuO[或Cu(OH)2、CuCO3、Cu2(OH)2CO3].此时溶液Ⅲ中的c(Fe3+)=2.6×10-9 mol•L-1.
④最后能不能直接加热CuCl2•2H2O得到CuCl2?不能(填“能”或“不能”).若能,不用回答;若不能,回答该如何操作?应在HCl气流中加热蒸发结晶.
分析 (1)Fe3+有强氧化性,能把金属铜氧化成铜离子;
(2)氯化亚铁和氯化铜的混合液中,加入氧化剂可以将亚铁离子氧化为铁离子,调节pH可以将铁离子沉淀,得到氯化铜的水溶液,然后再酸性环境下蒸发浓缩、冷却结晶,过滤、洗涤、干燥即可得到氯化铜晶体,
①加入氧化剂,将Fe2+氧化为Fe3+,易除去,据此回答;
②选择的氧化剂不能引进新的杂质离子是最佳氧化剂;
③在调节pH时,加入的物质不能引进新杂质;调至pH=4,c(OH-)=10-10mol/L,结合Ksp[Fe(OH)3]=2.6×10-39,来求解;
④铜离子水解溶液显示酸性,加热蒸干硫酸铜溶液得到的是氢氧化铜,据此回答;
解答 解:(1)Fe3+有强氧化性,能把金属铜氧化成铜离子,自身被还原成 Fe2+,反应方程式为2Fe3++Cu=2Fe2++Cu2+,故答案为:2Fe3++Cu=2Fe2++Cu2+;
根据流程图,氯化亚铁和氯化铜的混合液中,加入氧化剂可以将亚铁离子氧化为铁离子,调节pH可以将铁离子沉淀,得到氯化铜的水溶液,然后再酸性环境下蒸发浓缩、冷却结晶,过滤、洗涤、干燥即可得到氯化铜晶体,
(2)①根据实验目的,加入氧化剂的目的是将Fe2+氧化成Fe3+,便于生成Fe(OH)3沉淀而与Cu2+分离,
故答案为:将Fe2+氧化成Fe3+,便于生成Fe(OH)3沉淀而与Cu2+分离;
②K2Cr2O7、NaClO、H2O2、KMnO4都具有氧化性,能将亚铁离子氧化,但是K2Cr2O7、NaClO、KMnO4能引进新的杂质离子,双氧水是绿色氧化剂,得到的还原产物是水,不会引进杂质离子,故答案为:C;
③中和溶液的酸性,调节pH,将铁离子沉淀,铜离子不沉淀,可以加入CuO[或Cu(OH)2、CuCO3、Cu2(OH)2CO3],调至pH=4,c(OH-)=10-10mol/L,结合Ksp[Fe(OH)3]=2.6×10-39,所以c(Fe3+)=$\frac{2.6×1{0}^{-39}}{(1{0}^{-10})^{3}}$=2.6×10-9,故答案为:CuO[或Cu(OH)2、CuCO3、Cu2(OH)2CO3];2.6×10-9;
④铜离子水解溶液显示酸性,加热蒸干硫酸铜溶液得到的是氢氧化铜,为防止水解,应该在HCl气流中蒸干,
故答案为:不能;应在HCl气流中加热蒸发结晶.
点评 本题是一道物质的分离和提纯的实验方案设计题,题目考查的知识点较多,涉及氧化还原反应原理的应用、调节pH除杂质、盐的水解原理的应用等,考查学生分析解决问题以及灵活应用所学知识的能力,题目难度中等.

| 物质 | Cl2 | Br2 | I2 | H2 | HF | HCl | HBr | HI |
| 能量(kJ) | 243 | 193 | 151 | 436 | 565 | 431 | 363 | 297 |
(1)下列物质本身具有的能量最低的是A
A.H2 B.Cl2
C.Br2 D.I2
(2)下列氢化物中,最稳定的是A
A.HF B.HCl
C.HBr D.HI
(3)X2+H2═2HX(X代表F、Cl、Br)的反应是吸热反应还是放热反应:放热反应.
(4)相同条件下,X2(X代表F、Cl、Br)分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的热量最多的是氟气.
| A. | 由题目信息知:KMnO4的氧化性比MnO2的强 | |
| B. | 制备氯气的整个实验过程中,只需要使用氧化剂与还原剂 | |
| C. | 用排气法收集不需要利用其他试剂就能确定集气瓶中已收集满气体 | |
| D. | 用足量MnO2与含有4 molHCl的浓盐酸在加热条件下反应,得到Cl2的物质的量小于1 mol |
| A. | 40Wg | B. | 80ng | C. | 5(m-n)g | D. | mg |
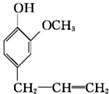 )可用于配制康乃馨型香精以及制异丁香酚和香兰素等,合成丁子香酚的一种路线如下:
)可用于配制康乃馨型香精以及制异丁香酚和香兰素等,合成丁子香酚的一种路线如下: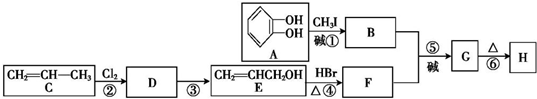
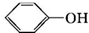 +RX$\stackrel{碱}{→}$
+RX$\stackrel{碱}{→}$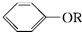 +HX(X代表卤素原子);
+HX(X代表卤素原子);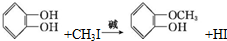 .
. .
.