题目内容
8.某无色透明溶液与金属铝反应放出氢气.下列离子:Mg2+、Cu2+、Ba2+、H+、Ag+、SO42-、HCO3-、OH-.判断何者能大量存在于此溶液中:(1)当生成Al3+时,一定大量存在H+、SO42-,可能存在Mg2+,一定不存在Ag+、Cu2+、Ba2+、HCO3-、OH-
(2)当生成AlO2-时,一定大量存在Ba2+、OH-,生成氢气的离子方程式是2Al+2OH-+2H2O=2AlO2-+3H2↑.
分析 溶液无色,则一定不存在有色的Cu2+离子;与金属铝反应放出H2,该溶液为酸性或强碱性溶液,
(1)当生成Al3+时,说明溶液呈酸性,因在含HNO3的溶液中放入Al不生成H2,则一定不存在NO3-离子,与H+离子反应的离子不能大量共存;
(2)当生成[Al(OH)4]-时,说明溶液呈碱性,溶液中存在大量的OH-离子,与OH-离子反应的离子不能大量共存,以此解答该题.
解答 解:溶液无色,则一定不存在Cu2+离子;与金属铝反应放出H2,该溶液为酸性或强碱性溶液,
(1)当生成Al3+时,说明溶液呈酸性,一定存在:H+,一定不存在:HCO3-、OH-,因在含HNO3的溶液中放入Al不生成H2,则一定不存在NO3-离子,酸性溶液中不存在HCO3-、OH-离子,根据溶液电荷守恒,则溶液中一定存在阴离子,即SO42-离子一定存在,而Ba2+、Ag+与SO42-离子生成难溶或微溶于水的沉淀,则一定不存在Ba2+、Ag+离子,则可能大量存在Mg2+,故答案为:H+、SO42-;Mg2+;Ag+、Cu2+、Ba2+、HCO3-、OH-;
(2)当生成[Al(OH)4]-时,说明溶液呈碱性,溶液中存在大量的OH-离子,与OH-离子反应的Mg2+、Cu2+、H+、Ag+、HCO3-离子不能大量存在,根据溶液电荷守恒,则溶液中一定存在阳离子,即Ba2+离子一定存在,而Ba2+与SO42-离子生成难溶于水的沉淀,则一定不存在SO42-离子,则一定大量存在OH-、Ba2+,金属铝可以和强碱之间反应生成偏铝酸盐和氢气,即2Al+2OH-+2H2O=2AlO2-+3H2↑;
故答案为:Ba2+、OH-;2Al+2OH-+2H2O=2 AlO2-+3H2↑.
点评 本题考查了离子共存的判断,题目难度中等,注意掌握离子反应发生条件,明确常见离子的性质及检验方法,试题侧重基础知识的考查,培养了学生灵活应用基础知识的能力.

 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式2Fe3++Cu=2Fe2++Cu2+.
(2)腐蚀铜板后的混合溶液中,为制取纯净的CuCl2,按如图步骤进行提纯:
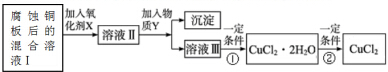
腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol•L-1,已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH,见下表:
| Fe3+ | Fe2+ | Cu2+ | |
| 氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 9.0 | 6.7 |
请回答下列问题:
①加入氧化剂的目的是将Fe2+氧化成Fe3+,便于生成Fe(OH)3沉淀而与Cu2+分离.
②最适合作氧化剂X的是C.
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
③加入Y物质,调至pH=4,加入的物质Y可能是CuO[或Cu(OH)2、CuCO3、Cu2(OH)2CO3].此时溶液Ⅲ中的c(Fe3+)=2.6×10-9 mol•L-1.
④最后能不能直接加热CuCl2•2H2O得到CuCl2?不能(填“能”或“不能”).若能,不用回答;若不能,回答该如何操作?应在HCl气流中加热蒸发结晶.
| A. | 分别加热两种样品,没有残留物质是NaHCO3 | |
| B. | 分别配成溶液,再加入石灰水,无白色沉淀生成的是NaHCO3 | |
| C. | 分别配成溶液,向其中逐滴加入同浓度的盐酸反应,先产生CO2的是NaHCO3 | |
| D. | 二者在一定条件下不能相互转化 |
| A. | 使苯酚显紫色的溶液:NH4+、K+、SCN-、NO3- | |
| B. | 加入铝粉产生氢气的溶液:Na+、K+、NO3-、Cl- | |
| C. | 澄清透明的溶液中:SO42-、K+、Cu2+、Cl- | |
| D. | 由水电离出的c(H+)•c(OH-)=10-22的溶液:Fe2+、Na+、NO3-、SO42- |

 氮氧化合物是大气污染的重要因素.
氮氧化合物是大气污染的重要因素.