题目内容
10.丁子香酚H(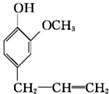 )可用于配制康乃馨型香精以及制异丁香酚和香兰素等,合成丁子香酚的一种路线如下:
)可用于配制康乃馨型香精以及制异丁香酚和香兰素等,合成丁子香酚的一种路线如下: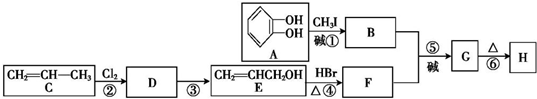
已知:
①
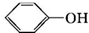 +RX$\stackrel{碱}{→}$
+RX$\stackrel{碱}{→}$ +HX(X代表卤素原子);
+HX(X代表卤素原子);②A与B相对分子质量之差为14;E与F相对分子质量之差为63;
③碳碳双键上不能连羟基;
④丁子香酚H由它的同分异构体G重排制得.
回答下列问题:
(1)下列有关丁子香酚的说法,正确的是AC.
A.遇FeCl3溶液可能显紫色 B.可发生酯化反应和银镜反应
C.能与溴发生取代和加成反应 D.1mol丁子香酚最多能与3molH2反应
(2)A的官能团名称为羟基;A生成B的化学方程式为
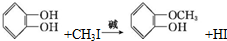 .
.(3)C生成D的反应类型为取代反应;D生成E的反应条件是NaOH的水溶液、加热.
(4)E生成F的化学方程式为CH2=CHCH2OH+HBr$\stackrel{△}{→}$CH2=CHCH2Br+H2O;
(5)写出与丁子香酚互为同分异构体且满足下列条件的结构简式(只写一种)
 .
.①属于芳香族化合物;②核磁共振氢谱有5组峰,且峰面积比为6:2:2:1:1;
③能发生银镜反应和水解反应.
分析 A与B相对分子质量之差为14,所以A发生信息①中的反应生成B为 ,根据题中各物质转化关系结合H的结构简式可知,C与氯气发生取代反应生成D为CH2=CHCH2Cl,D发生碱性水解得E为CH2=CHCH2OH,E与F相对分子质量之差为63,所以E与溴化氢发生取代生成F为CH2=CHCH2Br,B和F发生信息①中的反应生成G为
,根据题中各物质转化关系结合H的结构简式可知,C与氯气发生取代反应生成D为CH2=CHCH2Cl,D发生碱性水解得E为CH2=CHCH2OH,E与F相对分子质量之差为63,所以E与溴化氢发生取代生成F为CH2=CHCH2Br,B和F发生信息①中的反应生成G为 ,G再发生重排得H,据此答题.
,G再发生重排得H,据此答题.
解答 解:A与B相对分子质量之差为14,所以A发生信息①中的反应生成B为 ,根据题中各物质转化关系结合H的结构简式可知,C与氯气发生取代反应生成D为CH2=CHCH2Cl,D发生碱性水解得E为CH2=CHCH2OH,E与F相对分子质量之差为63,所以E与溴化氢发生取代生成F为CH2=CHCH2Br,B和F发生信息①中的反应生成G为
,根据题中各物质转化关系结合H的结构简式可知,C与氯气发生取代反应生成D为CH2=CHCH2Cl,D发生碱性水解得E为CH2=CHCH2OH,E与F相对分子质量之差为63,所以E与溴化氢发生取代生成F为CH2=CHCH2Br,B和F发生信息①中的反应生成G为 ,G再发生重排得H,
,G再发生重排得H,
(1)A.根据丁子香酚的结构简式可知,分子中有酚羟基,所以遇FeCl3溶液可能显紫色,故A正确;
B.丁子香酚分子中没有醛基,不能发生银镜反应,故B错误;
C.丁子香酚分子中有苯环和碳碳双键,能与溴发生取代和加成反应,故C正确;
D.根据丁子香酚的结构简式可知,1mol丁子香酚最多能与4molH2反,故D错误,
故选AC;
(2)根据A的结构简式可知,A的官能团名称为 羟基,A生成B的化学方程式为  ,
,
故答案:羟基; ;
;
(3)根据上面的分析可知,C生成D的反应类型为取代反应,D发生卤代烃的碱性水解得E,所以D生成E的反应条件是NaOH的水溶液、加热,
故答案为:取代反应;NaOH的水溶液、加热;
(4)E生成F的化学方程式为 CH2=CHCH2OH+HBr$\stackrel{△}{→}$CH2=CHCH2Br+H2O,
故答案为:CH2=CHCH2OH+HBr$\stackrel{△}{→}$CH2=CHCH2Br+H2O;
(5)根据条件:①属于芳香族化合物,即有苯环,②核磁共振氢谱有5组峰,且峰面积比为6:2:2:1:1,③能发生银镜反应和水解反应,说明有甲酸某酯,则符合条件的丁子香酚的同分异构体为 ,
,
故答案为: .
.
点评 本题考查有机物的推断与性质,涉及有机物的结构和性质,为高考常见题型,侧重于学生的分析能力的考查,注意把握有机物的结构特点和官能团的性质,难度不大.

| A. | 2:1 | B. | 1:2 | C. | 1:1 | D. | 3:2 |
| A. | 2LSO2和2LCO2 | B. | 9 g水和标准状况下 11.2LCO2 | ||
| C. | 标准状况下1mol氧气和 22.4L水 | D. | 0.1mol氢气和 2.24L氯化氢气体 |
| A. | 选用FeCl2、Cu2O、NaI等物质均能使题中反应发生 | |
| B. | 若用Na2S使题中反应发生则氧化过程的反应式一定为S2-+4H2O-8e-═SO42-+8H+ | |
| C. | 当收集到2.24 L(标准状况下)气体时,参与反应的HNO3为0.1 mol | |
| D. | 若将上述氧化还原反应设计成原电池,则题中反应在负极发生 |
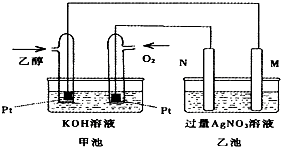
| A. | 若用此装置给铁棒上镀上层银,则N电极改用铁电极,M电极改用银电极 | |
| B. | 甲池中负极的电极反应式为:CH3CH2OH-12e-+3H2O=2CO2+12H+ | |
| C. | 甲池KOH溶液中经过0.05mol电子时,理论上乙池中的M电极质量增加5.04g | |
| D. | M电极上的电极反应式为:Ag++e-=Ag |
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式2Fe3++Cu=2Fe2++Cu2+.
(2)腐蚀铜板后的混合溶液中,为制取纯净的CuCl2,按如图步骤进行提纯:
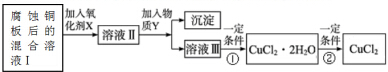
腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol•L-1,已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH,见下表:
| Fe3+ | Fe2+ | Cu2+ | |
| 氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 9.0 | 6.7 |
请回答下列问题:
①加入氧化剂的目的是将Fe2+氧化成Fe3+,便于生成Fe(OH)3沉淀而与Cu2+分离.
②最适合作氧化剂X的是C.
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
③加入Y物质,调至pH=4,加入的物质Y可能是CuO[或Cu(OH)2、CuCO3、Cu2(OH)2CO3].此时溶液Ⅲ中的c(Fe3+)=2.6×10-9 mol•L-1.
④最后能不能直接加热CuCl2•2H2O得到CuCl2?不能(填“能”或“不能”).若能,不用回答;若不能,回答该如何操作?应在HCl气流中加热蒸发结晶.
