题目内容
9.下表中的数据是破坏1 mol化学键所消耗的能量.| 物质 | Cl2 | Br2 | I2 | H2 | HF | HCl | HBr | HI |
| 能量(kJ) | 243 | 193 | 151 | 436 | 565 | 431 | 363 | 297 |
(1)下列物质本身具有的能量最低的是A
A.H2 B.Cl2
C.Br2 D.I2
(2)下列氢化物中,最稳定的是A
A.HF B.HCl
C.HBr D.HI
(3)X2+H2═2HX(X代表F、Cl、Br)的反应是吸热反应还是放热反应:放热反应.
(4)相同条件下,X2(X代表F、Cl、Br)分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的热量最多的是氟气.
分析 (1)破坏1mol 物质中的化学键所消耗的能量越高则说明物质越稳定,物质具有的能量越低;
(2)破坏1mol 物质中的化学键所消耗的能量越高则说明物质越稳定;
(3)根据新键生成放热情况和旧键断裂吸热情况来计算回答;
(4)破坏1mol物质中的化学键所消耗的能量越高,生成物越稳定,发生该反应放出的热量越多.
解答 解:(1)根据表中数据可知,破坏1mol氢气中的化学键所消耗的能量最高,则说明氢气最稳定,具有的能量最低,
故选:A;
(2)根据表中数据可知,破坏1molHF中的化学键所消耗的能量最高,则说明HF最稳定,
故选:A;
(3)根据反应X2+H2═2HX,可以计算新键生成释放的热量均大于旧键断裂吸收的热量,所以X2+H2═2HX的反应是放热反应,
故答案为:放热反应;
(4)根据表中数据可知,破坏1mol物质中的化学键所消耗的能量越高,生成物越稳定,发生该反应放出的热量越多,当消耗等物质的量的氢气时,氟气放出的热量最多,
故答案为:氟气.
点评 本题以卤族元素为例考查同一主族元素性质递变规律,为高频考点,明确化学键与反应能量之间关系是解本题关键,题目难度不大.

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
14.心脏起搏器一般是给心跳缓慢的病人使用.某种类型的心脏起搏器工作时发生下列反应:4Li+2SOCl2═4LiCl+S+SO2,下列有关判断正确的是( )
| A. | 还原剂只有锂 | |
| B. | SOCl2中每个原子都达到8电子稳定结构 | |
| C. | 氧化产物包括LiCl和SO2 | |
| D. | 生成1.12 LSO2时,反应转移电子为0.2 mol |
14.下列玻璃仪器中能用于直接加热的是( )
①蒸馏烧瓶 ②蒸发皿 ③试管 ④容量瓶 ⑤坩埚 ⑥量筒 ⑦烧杯.
①蒸馏烧瓶 ②蒸发皿 ③试管 ④容量瓶 ⑤坩埚 ⑥量筒 ⑦烧杯.
| A. | ②③⑤ | B. | ①③⑦ | C. | ④⑥ | D. | ③ |
1.已知3NO2+H2O═2HNO3+NO,则被氧化和被还原的氮原子个数比为( )
| A. | 2:1 | B. | 1:2 | C. | 1:1 | D. | 3:2 |
19.铁、铜单质及其化合物应用范围很广. 如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等.
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式2Fe3++Cu=2Fe2++Cu2+.
(2)腐蚀铜板后的混合溶液中,为制取纯净的CuCl2,按如图步骤进行提纯:
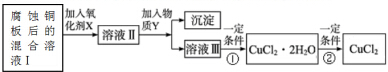
腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol•L-1,已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH,见下表:
25℃时,Ksp[Fe(OH)3]=2.6×10-39
请回答下列问题:
①加入氧化剂的目的是将Fe2+氧化成Fe3+,便于生成Fe(OH)3沉淀而与Cu2+分离.
②最适合作氧化剂X的是C.
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
③加入Y物质,调至pH=4,加入的物质Y可能是CuO[或Cu(OH)2、CuCO3、Cu2(OH)2CO3].此时溶液Ⅲ中的c(Fe3+)=2.6×10-9 mol•L-1.
④最后能不能直接加热CuCl2•2H2O得到CuCl2?不能(填“能”或“不能”).若能,不用回答;若不能,回答该如何操作?应在HCl气流中加热蒸发结晶.
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式2Fe3++Cu=2Fe2++Cu2+.
(2)腐蚀铜板后的混合溶液中,为制取纯净的CuCl2,按如图步骤进行提纯:

腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol•L-1,已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH,见下表:
| Fe3+ | Fe2+ | Cu2+ | |
| 氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 9.0 | 6.7 |
请回答下列问题:
①加入氧化剂的目的是将Fe2+氧化成Fe3+,便于生成Fe(OH)3沉淀而与Cu2+分离.
②最适合作氧化剂X的是C.
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
③加入Y物质,调至pH=4,加入的物质Y可能是CuO[或Cu(OH)2、CuCO3、Cu2(OH)2CO3].此时溶液Ⅲ中的c(Fe3+)=2.6×10-9 mol•L-1.
④最后能不能直接加热CuCl2•2H2O得到CuCl2?不能(填“能”或“不能”).若能,不用回答;若不能,回答该如何操作?应在HCl气流中加热蒸发结晶.