题目内容
4. 氧元素性质活泼,在众多的含氧化合物中氧元素显-2价,但也能形成一定数量的显正价的化合物.
氧元素性质活泼,在众多的含氧化合物中氧元素显-2价,但也能形成一定数量的显正价的化合物.(1)OF2是一种棕黄色有恶臭的气体,有极强的氧化性.
①OF2中氧元素的化合价为+2.
②将Fz通入稀的NaOH溶液中可得到OF2、盐等物质,相应反应的化学方程式为2F2+2NaOH=2NaF+H2O+OF2.
(2)过氧化氢是一种绿色氧化剂、还原剂,工业上有多种方法制备H2O2.
①研究表明,H2O2相当于二元弱酸,则它的一级电离方程式为H2O2?H++HO2-,已知常温下1L的H2O2相当于48.3mol,其K1≈1.67×10 -12.则该温度下H2O2中c(H+)约为9×10-6mol/L,写出它与足量Ba(OH)2反应的化学方程式为Ba(OH)2+H2O2=2H2O+BaO2.
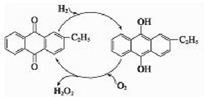
②乙基蒽醌法是制备过氧化氢最常用的方法,其主要过程可以用如图表示,写出此过程的总反应方程式H2+O2$\frac{\underline{\;催化剂\;}}{\;}$H2O2.
③空气阴极法制备H2O2是一种环境友好型、节能型制备方法,电解总方程式3H2O+3O2 $\frac{\underline{\;电解\;}}{\;}$3H2O2+O3,则阳极上电极反应式为2H2O-2e-=H2O2+2H+.
(3)氧也能与钾元素形成K2O、K202、KO2、KO3等氧化物,其中KO2是一种比Na2O2效率高的供氧剂,写出它与CO2反应的化学方程式4KO2+2CO2=2K2CO3+3O2.
分析 (1)①F元素为-1价,根据化合物中化合价的代数和为零计算;
②将Fz通入稀的NaOH溶液中可得到OF2、NaF和水;
(2)①双氧水可以可作是二元弱酸,说明双氧水分子能发生两步电离,第一步电离出一个氢离子;已知常温下1L的H2O2相当于48.3mol,K=$\frac{C({H}^{+})•C(H{{O}_{2}}^{-})}{C({H}_{2}{O}_{2})}$=1.67×10 -12,H2O2与Ba(OH)2作用形成正盐为BaO2,同时生成水;
②乙基蒽醌作催化剂,氢气和氧气反应生成双氧水;
③水在阳极上失电子生成双氧水;
(3)过氧化钠和二氧化碳反应生成碳酸钠和氧气,则超氧化钾和二氧化碳反应生成碳酸钾和氧气.
解答 解:(1)①F元素为-1价,化合物中化合价的代数和为零,则OF2中O为+2价,故答案为:+2;
②将Fz通入稀的NaOH溶液中可得到OF2、NaF和水,其反应方程式为:2F2+2NaOH=2NaF+H2O+OF2,故答案为:2F2+2NaOH=2NaF+H2O+OF2;
(2)①双氧水可以可作是二元弱酸,说明双氧水分子能发生两步电离,第一步电离出一个氢离子,则它的一级电离方程式为H2O2?H++HO2-;根据K=$\frac{C({H}^{+})•C(H{{O}_{2}}^{-})}{C({H}_{2}{O}_{2})}$=1.67×10 -12,则c(H+)=$\sqrt{1.67×1{0}^{-12}×48.3}$=9×10-6mol/L;H2O2与Ba(OH)2作用形成正盐为BaO2,同时生成水,其反应的方程式为:H2O2+Ba(OH)2=BaO2+2H2O;
故答案为:H2O2?H++HO2-;9×10-6mol/L;H2O2+Ba(OH)2=BaO2+2H2O;
②通过图示可知,用乙基蒽醌作催化剂制取双氧水,反应为:H2+O2$\frac{\underline{\;催化剂\;}}{\;}$H2O2,
故答案为:H2+O2$\frac{\underline{\;催化剂\;}}{\;}$H2O2;
③电解总方程式3H2O+3O2$\frac{\underline{\;电解\;}}{\;}$3H2O2+O3,水在阳极上失电子生成双氧水,其电极方程式:2H2O-2e-=H2O2+2H+,
故答案为:2H2O-2e-=H2O2+2H+;
(3)过氧化钠和二氧化碳反应生成碳酸钠和氧气,则超氧化钾和二氧化碳反应生成碳酸钾和氧气,反应方程式为4KO2+2CO2=2K2CO3+3O2,
故答案为:4KO2+2CO2=2K2CO3+3O2.
点评 本题是一道综合知识题目,涉及化合价、弱电解质的电离、电离常数的应用、电解原理的应用、化学方程式的书写等,考查学生分析和解决问题的能力,题目难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | 铁有剩余 | |
| B. | 往溶液中滴入无色KSCN溶液,显红色 | |
| C. | Fe2+和Fe3+物质的量之比为6:1 | |
| D. | 氧化产物与还原产物的物质的量之比为2:5 |
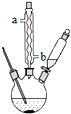 苯甲酸钠是一种常见的食品防腐剂.实验室制备苯甲酸的反应装置如图,有关数据如表:
苯甲酸钠是一种常见的食品防腐剂.实验室制备苯甲酸的反应装置如图,有关数据如表:| 相对分子质量 | 熔点/℃ | 沸点/℃ | 溶解性 | |
| 甲苯 | 92 | -94.9 | 110.6 | 难溶于水 |
| 苯甲酸 | 122 | 122.13 | 249 | 微溶于水 |
| 苯甲酸钠 | 144 | - | 249.3 | 易溶于水 |
(1)制备苯甲酸
在三颈瓶中加入4mL甲苯和20mL稀硫酸,放入碎瓷片后,加热至沸腾,加入12.8g高锰酸钾,加热到甲苯层消失.将三颈瓶在冰水浴中冷却,分离出苯甲酸.
①球形冷凝管的作用是冷凝回流,其进水口是b(填“a”或“b”).
②三颈瓶中反应的离子方程式
 .
.③分离苯甲酸选用的玻璃仪器是BCD(填标号)
A分液漏斗 B玻璃棒 C烧杯 D漏斗 E蒸馏烧瓶 F直形冷凝管
④分离出的苯甲酸晶体中可能含有的杂质是K2SO4、MnSO4,为进一步提纯,应采用的方法是重结晶.
(2)制备苯甲酸钠
控制温度为70℃,向三颈瓶中加入61.0g苯甲酸和适量的32%的碳酸钠溶液,充分反应后停止加热.在深色的溶液中加入活性炭,并将反应混合物过滤,得到无色透明的苯甲酸钠溶液,将滤液转入蒸发皿中,加热蒸发、冷却结晶,过滤、洗涤、干燥制得苯甲酸钠晶体.
⑤控制温度为70℃的方法是水浴加热.
⑥加入活性炭的作用是吸附色素.
⑦若提纯得到46.8g苯甲酸钠.则苯甲酸钠的产率是65.0%.
| A. | 天津港爆炸残留的剧毒物 NaCN,利用双氧水将其氧化为 NaHCO3 和 NH3降低毒性 | |
| B. | 氢氧化铁溶胶、水玻璃、淀粉溶液、PM2.5 微粒均具有丁达尔效应 | |
| C. | 二氧化硅不与任何酸反应,可用石英制造耐酸容器 | |
| D. | 氢氧化钠可作胃酸的中和剂 |

| A. | (C6H10O5)n 可表示淀粉或纤维素 | |
| B. | 反应②化学方程式为 C6H12O6$\stackrel{酒化酶}{→}$2C2H5OH+2CO2↑ | |
| C. | 反应③得到的乙酸乙酯中含有乙醇和乙酸,可用饱和氢氧化钠溶液除去 | |
| D. | 反应③和④都属于取代反应 |
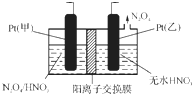 氮氧化物是造成雾霾天气的主要原因之一.消除氮氧化物有多种方法.
氮氧化物是造成雾霾天气的主要原因之一.消除氮氧化物有多种方法.