题目内容
7.硫酸亚铁铵晶体[化学式为x(NH4)2SO4•yFeSO4•zH2O]呈浅绿色,易溶于水,不溶于酒精,是一种重要的化学试剂.某化学兴趣小组设计以下实验制备并定量测定其组成.已知:
| 温度、溶解度、物质 | (NH4)2SO4 | FeSO4•7H2SO4 | 硫酸亚铁铵晶体 |
| 10 | 73.0 | 40.0 | 18.1 |
| 20 | 75.4 | 48.0 | 21.1 |
| 30 | 78.0 | 60.0 | 24.5 |
| 40 | 81.0 | 73.3 | 27.9 |
| 50 | 84.5 | - | 31.3 |
| 70 | 91.9 | - | 38.5 |
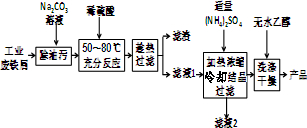
Ⅰ.硫酸亚铁铵晶体的制备(如图所示)
(1)Na2CO3溶液能用于除油污的原因是(用离子方程式表示)CO32-+H2O?HCO3-+OH-.
(2)加入适量(NH4)2SO4后,经加热浓缩、冷却结晶、过滤就能得到硫酸亚铁铵晶体的原因是相同温度下,硫酸亚铁铵晶体在水中的溶解度小于(NH4)2SO4、FeSO4•7H2O.
(3)用无水乙醇除去硫酸亚铁铵晶体表面的水分,而不能在空气中直接烘干的原因是防止在加热过程中晶体失去结晶水及被氧化.
Ⅱ.定量测定硫酸亚铁铵晶体的组成
步骤1:结晶水的测定
(4)准确称量47.040g纯净的硫酸亚铁铵晶体并隔绝空气加热至恰好失去结晶水,称得剩余固体34.080g,则n(结晶水)=0.72mol.再将全部剩余固体溶于水配成250mL溶液.
步骤2:Fe2+的测定
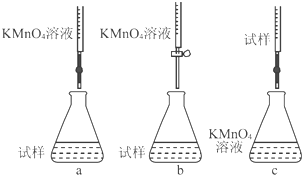
(5)取25.00mL步骤1中所配溶液于锥形瓶中,将0.1000mol/L 酸性高锰酸钾标准溶液装入
酸式滴定管中进行滴定,反应的离子方程式为5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,滴定至终点的现象是滴入最后一滴标准液时,锥形瓶内溶液变为紫红色,且半分钟不恢复原色,共计消耗酸性高锰酸钾标准溶液24.00mL.
步骤3:SO42-的测定 向25.00mL步骤1中所配溶液中加入足量BaCl2溶液后,经过滤、洗涤、干燥后,称量沉淀质量为5.592g.
步骤4:计算
(6)x:y:z=1:1:6.
分析 Ⅰ.(1)Na2CO3水解溶液呈碱性,碱性溶液能用于除油污;
(2)根据表中的溶解度数据可知,相同温度下,硫酸亚铁铵晶体在水中的溶解度小于(NH4)2SO4、FeSO4•7H2O,据此答题;
(3)硫酸亚铁铵在加热过程中晶体失去结晶水及被氧化且容易被氧化;
Ⅱ.(4)根据47.040g纯净的硫酸亚铁铵和剩余固体34.080g的质量比可知水的质量,进而计算出水的物质的量;
(5)酸性高锰酸钾标准溶液有强氧化性,亚铁离子与高锰酸钾发生氧化还原反应生成铁离子和锰离子,在滴定终点时锥形瓶内溶液变为紫红色,据此答题;
(6)根据步骤1可知水的物质的量,根据步骤2中关系式5Fe2+~MnO4-,可计算出亚铁离子的物质的量,根据步骤3中BaSO4沉淀质量为5.592g,可知硫酸根离子的物质的量.
解答 解:Ⅰ.(1)Na2CO3水解溶液呈碱性,碱性溶液能用于除油污,反应的离子方程式为CO32-+H2O?HCO3-+OH-,
故答案为:CO32-+H2O?HCO3-+OH-;
(2)根据表中的溶解度数据可知,相同温度下,硫酸亚铁铵晶体在水中的溶解度小于(NH4)2SO4、FeSO4•7H2O,所以加入适量(NH4)2SO4后,经加热浓缩、冷却结晶、过滤就能得到硫酸亚铁铵晶体,
故答案为:相同温度下,硫酸亚铁铵晶体在水中的溶解度小于(NH4)2SO4、FeSO4•7H2O;
(3)硫酸亚铁铵在加热过程中晶体失去结晶水及被氧化且容易被氧化,所以用无水乙醇除去硫酸亚铁铵晶体表面的水分,而不能在空气中直接烘干,
故答案为:防止在加热过程中晶体失去结晶水及被氧化;
Ⅱ.(4)根据47.040g纯净的硫酸亚铁铵和剩余固体34.080g的质量比可知水的质量为47.040g-34.080g=12.96g,所以水的物质的量为0.72mol,
故答案为:0.72mol;
(5)酸性高锰酸钾标准溶液有强氧化性,所以要用酸式滴定管,亚铁离子与高锰酸钾发生氧化还原反应生成铁离子和锰离子,反应的离子方程式为5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,滴定至终点的现象是滴入最后一滴标准液时,锥形瓶内溶液变为紫红色,且半分钟不恢复原色,
故答案为:酸;5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;滴入最后一滴标准液时,锥形瓶内溶液变为紫红色,且半分钟不恢复原色;
(6)根据步骤1可知水的物质的量为0.72mol,根据步骤2中关系式5Fe2+~MnO4-,可计算出亚铁离子的物质的量为5×0.1000mol/L×0.024L×$\frac{250}{25}$=0.12mol,根据步骤3中BaSO4沉淀质量为5.592g即为$\frac{5.592}{233}$mol=0.024mol,可知硫酸根离子的物质的量为为0.024mol×$\frac{250}{25}$=0.24mol,所以x:y:z=0.12mol:(0.024mol-0.12mol):0.72mol=1:1:6,
故答案为:1:1:6.
点评 本题考查化学工艺流程、盐类水解、化学实验等,难度中等,需要学生具有扎实的基础与运用知识分析解决问题的能力,注意基础知识的理解掌握.

| A. | 在水溶液中,乙硫醇比乙醇更难电离出H+离子 | |
| B. | 乙硫醇在空气中燃烧生成二氧化碳、三氧化硫和水 | |
| C. | 甲硫醇、乙硫醇与丁硫醇互为同系物 | |
| D. | 沸点不同的丁硫醇有两种 |
①HCl易溶于水②I2微溶于水③C12能溶于水④NH3易溶于水.
| A. | ①②③ | B. | ①③④ | C. | ②③④ | D. | ①②④ |
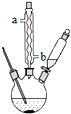 苯甲酸钠是一种常见的食品防腐剂.实验室制备苯甲酸的反应装置如图,有关数据如表:
苯甲酸钠是一种常见的食品防腐剂.实验室制备苯甲酸的反应装置如图,有关数据如表:| 相对分子质量 | 熔点/℃ | 沸点/℃ | 溶解性 | |
| 甲苯 | 92 | -94.9 | 110.6 | 难溶于水 |
| 苯甲酸 | 122 | 122.13 | 249 | 微溶于水 |
| 苯甲酸钠 | 144 | - | 249.3 | 易溶于水 |
(1)制备苯甲酸
在三颈瓶中加入4mL甲苯和20mL稀硫酸,放入碎瓷片后,加热至沸腾,加入12.8g高锰酸钾,加热到甲苯层消失.将三颈瓶在冰水浴中冷却,分离出苯甲酸.
①球形冷凝管的作用是冷凝回流,其进水口是b(填“a”或“b”).
②三颈瓶中反应的离子方程式
 .
.③分离苯甲酸选用的玻璃仪器是BCD(填标号)
A分液漏斗 B玻璃棒 C烧杯 D漏斗 E蒸馏烧瓶 F直形冷凝管
④分离出的苯甲酸晶体中可能含有的杂质是K2SO4、MnSO4,为进一步提纯,应采用的方法是重结晶.
(2)制备苯甲酸钠
控制温度为70℃,向三颈瓶中加入61.0g苯甲酸和适量的32%的碳酸钠溶液,充分反应后停止加热.在深色的溶液中加入活性炭,并将反应混合物过滤,得到无色透明的苯甲酸钠溶液,将滤液转入蒸发皿中,加热蒸发、冷却结晶,过滤、洗涤、干燥制得苯甲酸钠晶体.
⑤控制温度为70℃的方法是水浴加热.
⑥加入活性炭的作用是吸附色素.
⑦若提纯得到46.8g苯甲酸钠.则苯甲酸钠的产率是65.0%.
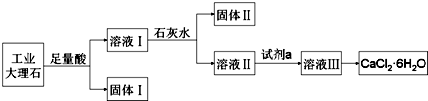
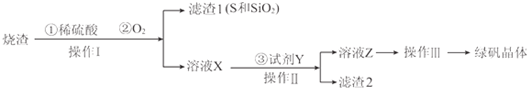
下列说法不正确的是( )
| A. | 固体Ⅰ中含有SiO2,固体Ⅱ中含有Fe(OH)3 | |
| B. | 使用石灰水时,要控制pH,防止固体Ⅱ中Al(OH)3转化为AlO2- | |
| C. | 试剂a选用盐酸,从溶液Ⅲ得到CaCl2•6H2O产品的过程中,须控制条件防止其分解 | |
| D. | 若改变实验方案,在溶液Ⅰ中直接加氨水至沉淀完全,滤去沉淀,其溶液经蒸发浓缩、冷却结晶也可得到纯净CaCl2•6H2O |
| A. | 天津港爆炸残留的剧毒物 NaCN,利用双氧水将其氧化为 NaHCO3 和 NH3降低毒性 | |
| B. | 氢氧化铁溶胶、水玻璃、淀粉溶液、PM2.5 微粒均具有丁达尔效应 | |
| C. | 二氧化硅不与任何酸反应,可用石英制造耐酸容器 | |
| D. | 氢氧化钠可作胃酸的中和剂 |

| A. | (C6H10O5)n 可表示淀粉或纤维素 | |
| B. | 反应②化学方程式为 C6H12O6$\stackrel{酒化酶}{→}$2C2H5OH+2CO2↑ | |
| C. | 反应③得到的乙酸乙酯中含有乙醇和乙酸,可用饱和氢氧化钠溶液除去 | |
| D. | 反应③和④都属于取代反应 |