题目内容
7.工业上用白云石制备高纯氧化镁的工艺流程如下: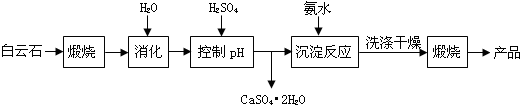
已知Ⅰ.白云石主要成分可表示为:CaO 32.50%;MgO 20.58%;Fe2O32.18%;SiO2 0.96%;其他 43.78%.
(1)为了提高白云石的煅烧效果,可以采取的措施是将矿石粉碎.若在实验室中煅烧白云石,需要的仪器除酒精灯、三脚架以外,还需要BC(填序号).
A.蒸发皿 B.坩埚 C.泥三角 D.石棉网
(2)加入H2SO4控制pH时,终点pH对产品的影响如图所示.则由图示可得到的结论及原因是:
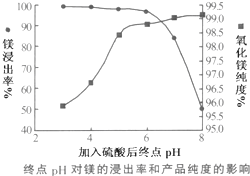
①pH过高会导致镁浸出率降低下降,其原因是Mg(OH)2或MgO未完全溶解
②pH过低会引起产品纯度下降,其原因可能是AC(填序号)
A.Fe2O3溶于H2SO4最终使产品混有杂质
B.SiO2溶于H2SO4最终使产品混有杂质
C.酸性过强,形成可溶的Ca(HSO4)2,最终使产品混有含钙的杂质
(3)已知MgSO4、CaSO4的溶解度如下表:
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
(4)写出沉淀反应中的离子方程式:Mg2++2NH3.H2O═Mg(OH)2↓+2NH4+.
(5)该生产流程中还可得到的一种副产品是(NH4)2SO4.
(6)已知酸碱指示剂百里酚蓝变色的pH范围如表所示:25℃时,向Mg(OH)2的饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色为蓝色(25℃时,Mg(OH)2的溶度积Ksp=5.6×10-12).
| pH | <8.0 | 8.0~9.6 | >9.6 |
| 颜色 | 黄色 | 绿色 | 蓝色 |
分析 白云石煅烧后加水消化,再加硫酸调节pH值,得到硫酸钙晶体沉淀,过滤后得滤液主要是硫酸镁溶液,加入氨水得氢氧化镁沉淀,同时得到硫酸铵溶液,氢氧化镁沉淀经洗涤、干燥、煅烧得高纯氧化镁.
(1)对矿石进行粉碎,增大反应的接触面积,从而加快反应速率;若在实验室煅烧白云石,煅烧需要的配套装置有酒精灯、三脚架、坩埚、泥三角坩、埚钳等;
(2)①曲线上打小方点的是氧化镁的纯度,该纯度随着pH的增大呈现出增大的趋势,而曲线上打黑点的是镁浸出率曲线,该曲线随着pH的增大,呈现出逐渐下降的趋势,且当pH>6时,浸出率下降得越来越快,应是pH过高沉淀中氧化镁、氢氧化镁没有溶解;
②pH过低会引起制得的氧化镁的纯度偏低,白云石中的氧化物杂质Fe2O3、CaO都会溶于硫酸,并且生成可溶的物质;
(3)由表中数据可知,硫酸镁易溶于水,溶解度随温度升高而升高,而硫酸钙则微溶于水,随着温度升高溶解度基本不变,所以利用二者溶解度上的差异,若要析出硫酸钙晶体来,可以采取的措施是升温结晶、趁热过滤;
(4)沉淀步骤中反应池中的主要为镁离子,所以加入氨水,氨水和镁离子结合生成沉淀氢氧化镁,注意氨水不能拆;
(5)当沉淀步骤析出Mg(OH)2后,溶液还剩下NH4+和SO42-,利用此剩余溶液制得副产品(NH4)2SO4;
(6)饱和的氢氧化镁溶液存在Mg(OH)2(s)=Mg2+(aq)+2 OH-(aq)溶解平衡,2c(Mg2+)=c(OH-),根据溶度积Ksp=c(Mg2+)×c2(OH-)=5.6×10-12,计算出c(OH-),再计算pH判断.
解答 解:白云石煅烧后加水消化,再加硫酸调节pH值,得到硫酸钙晶体沉淀,过滤后得滤液主要是硫酸镁溶液,加入氨水得氢氧化镁沉淀,同时得到硫酸铵溶液,氢氧化镁沉淀经洗涤、干燥、煅烧得高纯氧化镁.
(1)提高矿石煅烧效果的措施通常是对矿石进行粉碎处理,以增大反应的接触面积,从而加快反应速率,使煅烧更加充分.若在实验室煅烧白云石,煅烧需要的配套装置有酒精灯、三脚架、坩埚、泥三角坩、埚钳等,必须选BC,
故答案为:粉碎;BC;
(2)①曲线上打小方点的是氧化镁的纯度,该纯度随着pH的增大呈现出增大的趋势,而曲线上打黑点的是镁浸出率曲线,该曲线随着pH的增大,呈现出逐渐下降的趋势,且当pH>6时,浸出率下降得越来越快,应是pH过高沉淀中氧化镁、氢氧化镁没有溶解,
故答案为:镁浸出率降低; Mg(OH)2或MgO未完全溶解;
②pH过低会引起制得的氧化镁的纯度偏低,原因是白云石中的氧化物杂质Fe2O3、CaO都会溶于硫酸,并且生成可溶的物质,所以AC均有可能,
故答案为:产品纯度下降;AC;
(3)由表中数据可知,硫酸镁易溶于水,溶解度随温度升高而升高,而硫酸钙则微溶于水,随着温度升高溶解度基本不变,所以利用二者溶解度上的差异,若要析出硫酸钙晶体来,可以采取的措施是升温结晶、趁热过滤,
故答案为:升温结晶、趁热过滤;
(4)沉淀步骤中反应池中的主要为镁离子,所以加入氨水,氨水和镁离子结合生成沉淀氢氧化镁,所以离子方程式是Mg2++2NH3.H2O═Mg(OH)2↓+2NH4+,
故答案为:Mg2++2NH3.H2O═Mg(OH)2↓+2NH4+;
(5)当沉淀步骤析出Mg(OH)2后,溶液还剩下NH4+和SO42-,所以可以利用此剩余溶液制得副产品(NH4)2SO4,可用于做氮肥,
故答案为:(NH4)2SO4;
(6)饱和的氢氧化镁溶液存在Mg(OH)2(s)=Mg2+(aq)+2 OH-(aq)溶解平衡,2c(Mg2+)=c(OH-),又溶度积Ksp=c(Mg2+)×c2(OH-)=5.6×10-12,由此可以得出c(OH-)=3.6×10-4,所以pH>9.6,所以加入百里酚蓝指示剂,溶液呈蓝色,
故答案为:蓝色.
点评 本题以物质制备为载体,考查物质的分离提纯、条件控制选择、实验基本操作、溶度积有关计算以及对原理的分析等,理解利用溶解度的差别进行物质的分离提纯,较好的考查学生分析和解决问题的能力.

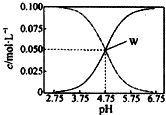 25℃时,有均满足c(CH3COO- )+c(CH3COOH)=0.10mol/L的醋酸与醋酸钠的混合溶液系列,在溶液中c(CH3COOH)、c(CH3COO- )与pH的关系如图所示.下列有关溶液中离子浓度关系的叙述中,不正确的是( )
25℃时,有均满足c(CH3COO- )+c(CH3COOH)=0.10mol/L的醋酸与醋酸钠的混合溶液系列,在溶液中c(CH3COOH)、c(CH3COO- )与pH的关系如图所示.下列有关溶液中离子浓度关系的叙述中,不正确的是( )| A. | 25℃时,醋酸的电离常数K=1.0×10-4.75 | |
| B. | W点表示的溶液中:c(CH3COO-)=c(CH3COOH)>c( Na+) | |
| C. | pH=5.5的溶液中:c(CH3COOH)>c(CH3COO- )>c(H+)>c(OH- ) | |
| D. | pH=4.0的溶液中:c( Na+)+c(H+)+c(CH3COOH)-c(OH- )=0.10mol/L |
| A. | BaC03是难溶于水的强电解质,在医学上用作钡餐 | |
| B. | 常用电解熔融氯化铝和冰晶石的混合物方法冶炼铝 | |
| C. | 明矾净水,硫酸铜溶液作农药,都与金属离子的水解有关 | |
| D. | 锅炉水垢中含有的CaSO4,可先用饱和碳酸钠溶液处理,而后用盐酸除去 |
| A. | 化合物都是由不同元素组成的,不同元素组成的物质一定是化合物 | |
| B. | 金属镁排在金属活动性顺序表中氢元素的前面,所以镁与酸反应一定放出氢气 | |
| C. | 中和反应都有盐和水生成,有盐和水生成的反应都属于中和反应 | |
| D. | 氧化还原反应有元素化合价变化,有元素化合价变化的反应一定是氧化还原反应 |
| A. | 苯、乙醇和乙酸都能发生取代反应 | |
| B. | 等物质的量的乙醇和乙酸完全燃烧时所需氧气的质量相等 | |
| C. | 乙醇、乙酸和乙酸乙酯能用饱和NaHCO3溶液鉴别 | |
| D. | 乙烷和丙烯的物质的量各1mol,完成燃烧生成3molH2O |
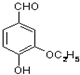 是食品添加剂的增香原料,其香味比香草醛更浓郁.
是食品添加剂的增香原料,其香味比香草醛更浓郁.
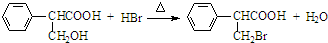 ,属于取代反应(填反应类型).
,属于取代反应(填反应类型). .
. .
.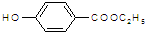 )是一种医药中间体,请设计合理方案用
)是一种医药中间体,请设计合理方案用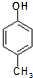 合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件).
合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件). $\stackrel{CH_{3}I}{→}$
$\stackrel{CH_{3}I}{→}$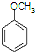 $\stackrel{HI}{→}$
$\stackrel{HI}{→}$ $→_{催化剂}^{H_{2}△}$
$→_{催化剂}^{H_{2}△}$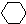 $→_{光照}^{Br_{2}}$
$→_{光照}^{Br_{2}}$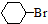
 .
.