题目内容
16.用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )①12.4g白磷晶体中含有的P-P键数约是0.6NA
②电解精炼铜时转移了NA个电子,阳极溶解32g铜
③7.8g Na2S和Na2O2的固体混合物中含有的阴离子数大于0.1NA
④CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)?2CO(g)+O2(g)△H=+2×283.0kJ/mol
⑤2.9g 2CaSO4•H2O含有的结晶水分子数为0.02NA
⑥含0.2mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1NA
⑦含0.1mol溶质Na2CO3的溶液中,所含阴离子总数大于0.1NA.
| A. | ①④⑤⑦ | B. | ①④⑦ | C. | ①③④⑤⑥ | D. | ②③⑤⑥ |
分析 ①求出白磷的物质的量,然后根据1mol白磷中含6molP-P键来分析;
②电解精炼铜时,阳极放电的不止是铜;
③Na2S和Na2O2均由2个钠离子和1个阴离子构成;
④CO(g)的燃烧热是283.0kJ/mol,即1molCO完全燃烧生成二氧化碳气体时放出的热量为283KJ;
⑤求出2CaSO4•H2O的物质的量,然后根据1mol2CaSO4•H2O中含1mol水分子来分析;
⑥铜只能与浓硫酸反应,和稀硫酸不反应;
⑦由于CO32-的水解,会导致阴离子个数增多.
解答 解:①12.4g白磷的物质的量为n=$\frac{12.4g}{124g/mol}$=0.1mol,而1mol白磷中含6molP-P键,故0.1mol白磷中含0.6molP-P键即0.6NA条,故①正确;
②电解精炼铜时,阳极放电的不止是铜,还有比铜活泼的杂质,故当转移了NA个电子时,阳极上溶解的铜的质量小于32g,故②错误;
③Na2S和Na2O2的摩尔质量均为78g/mol,故7.8g混合物的物质的量为0.1mol,而两者均由2个钠离子和1个阴离子构成,故0.1mol混合物中含有的阴离子个数为0.1NA个,故③错误;
④CO(g)的燃烧热是283.0kJ/mol,即1molCO完全燃烧生成二氧化碳气体时放出的热量为283KJ,故有:2CO(g)+O2(g)?2CO2(g)△H=-2×283.0kJ/mol,故2CO2(g)?2CO(g)+O2(g)△H=+2×283.0kJ/mol,故④正确;
⑤2.9g 2CaSO4•H2O的物质的量为n=$\frac{2.9g}{290g/mol}$=0.01mol,而1mol2CaSO4•H2O中含1mol水分子,故0.01mol 2CaSO4•H2O中含0.01mol水即0.01NA个水分子,故⑤错误;
⑥铜只能与浓硫酸反应,和稀硫酸不反应,故浓硫酸不能反应完全,故生成的二氧化硫分子个数小于0.1NA个,故⑥错误;
⑦由于CO32-的水解,会导致阴离子个数增多,即多于0.1NA个,故⑦正确.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

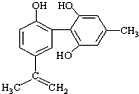 体育竞技中服用兴奋剂既有失公平,也败坏了体育道德.某种兴奋剂的结构简式如图所示.有关该物质的说法中,正确的是( )
体育竞技中服用兴奋剂既有失公平,也败坏了体育道德.某种兴奋剂的结构简式如图所示.有关该物质的说法中,正确的是( )| A. | 1mol该物质分别与浓溴水和H2反应时最多消耗和分别为4mol和7mol | |
| B. | 滴入酸性高锰酸钾溶液振荡,紫色褪去,能证明其结构中存在碳碳双键 | |
| C. | 该物质与苯酚属于同系物,遇溶液呈紫色 | |
| D. | 该分子中的所有碳原子不可能共平面 |
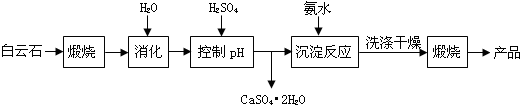
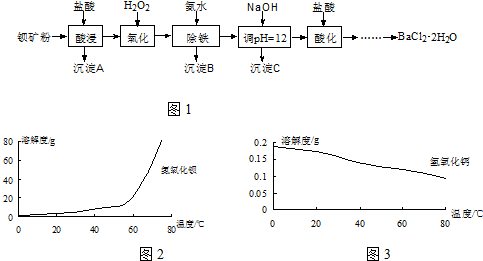
已知Ⅰ.白云石主要成分可表示为:CaO 32.50%;MgO 20.58%;Fe2O32.18%;SiO2 0.96%;其他 43.78%.
(1)为了提高白云石的煅烧效果,可以采取的措施是将矿石粉碎.若在实验室中煅烧白云石,需要的仪器除酒精灯、三脚架以外,还需要BC(填序号).
A.蒸发皿 B.坩埚 C.泥三角 D.石棉网
(2)加入H2SO4控制pH时,终点pH对产品的影响如图所示.则由图示可得到的结论及原因是:
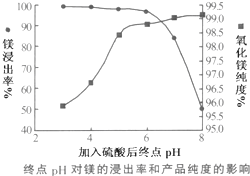
①pH过高会导致镁浸出率降低下降,其原因是Mg(OH)2或MgO未完全溶解
②pH过低会引起产品纯度下降,其原因可能是AC(填序号)
A.Fe2O3溶于H2SO4最终使产品混有杂质
B.SiO2溶于H2SO4最终使产品混有杂质
C.酸性过强,形成可溶的Ca(HSO4)2,最终使产品混有含钙的杂质
(3)已知MgSO4、CaSO4的溶解度如下表:
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
(4)写出沉淀反应中的离子方程式:Mg2++2NH3.H2O═Mg(OH)2↓+2NH4+.
(5)该生产流程中还可得到的一种副产品是(NH4)2SO4.
(6)已知酸碱指示剂百里酚蓝变色的pH范围如表所示:25℃时,向Mg(OH)2的饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色为蓝色(25℃时,Mg(OH)2的溶度积Ksp=5.6×10-12).
| pH | <8.0 | 8.0~9.6 | >9.6 |
| 颜色 | 黄色 | 绿色 | 蓝色 |
| A. | 烧碱溶液 | B. | 盐酸 | C. | 稀硝酸 | D. | 浓硝酸 |
| A. | 甲酸甲酯的结构简式:CH2O | |
| B. | Na+的.结构示意图: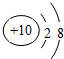 | |
| C. | 质子数为53、中子数为78的碘原子:${\;}_{53}^{131}$I | |
| D. | CO2的电子式为: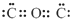 |
| 溶质 | NaF | NaClO | Na2CO3 |
| pH | 7.5 | 9.7 | 11.6 |
| A. | 在相同温度下,同浓度的三种酸溶液的导电能力顺序:H2CO3<HClO<HF | |
| B. | 若将0.2 mol•L-1Na2CO3和0.1 mol•L-1NaHCO3溶液等体积混合,则溶液中:3c(OHˉ)=3c(H+)+2c(HCO3ˉ)+5c(H2CO3)+c(CO32ˉ) | |
| C. | 根据上表,反应ClOˉ+H2O?HClO+OHˉ的水解常数Kh≈10ˉ7.6 | |
| D. | 向上述NaClO 溶液中通HF气体至恰好完全反应时:c(Na+)>c(Fˉ)>c(H+)>c(HClO)>c(OH-) |
| A. | 最外层电子数大于4 | B. | 具有负化合价 | ||
| C. | 最高价氧化物对应水化物是酸 | D. | 具有可变化合价 |