题目内容
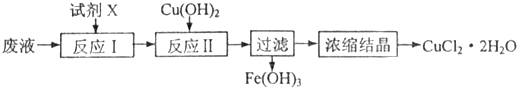
MnO2是一种重要的无机功能材料,粗MnO2的提纯是工业生产的重要环节.某研究性学习小组设计了将粗MnO2(含有较多的MnO和MnCO3)样品转化为纯MnO2实验,其流程如下:

(1)第①步加稀H2SO4时,粗MnO2样品中的 (写化学式)转化为可溶性物质.
(2)完成第②步反应的离子方程式并配平:
□ +□ClO3-+□ =□MnO2↓+□Cl2↑+□ .
(3)第③步蒸发操作必需的仪器有铁架台(含铁圈)、酒精灯、 、 .
已知蒸发得到的固体中含有NaClO3和NaOH,则一定还含有 (写化学式).
(4)用浓硫酸来配制本实验需要的稀硫酸,进行如下操作,其中会使所配溶液浓度偏高的是
A 用量筒量取浓硫酸倒入小烧杯后,用蒸馏水洗涤量筒并将洗涤液转移到小烧杯中
B 定容时仰视
C用量筒量取浓硫酸时,读数时仰视
D容量瓶中有水,未进行干燥
(5)若粗MnO2样品的质量为12.69g,第①步反应后,经过滤得到8.7g MnO2,并收集到0.224L CO2(标准状况下),则在第②步反应中至少需要 mol NaClO3.

(1)第①步加稀H2SO4时,粗MnO2样品中的
(2)完成第②步反应的离子方程式并配平:
□
(3)第③步蒸发操作必需的仪器有铁架台(含铁圈)、酒精灯、
已知蒸发得到的固体中含有NaClO3和NaOH,则一定还含有
(4)用浓硫酸来配制本实验需要的稀硫酸,进行如下操作,其中会使所配溶液浓度偏高的是
A 用量筒量取浓硫酸倒入小烧杯后,用蒸馏水洗涤量筒并将洗涤液转移到小烧杯中
B 定容时仰视
C用量筒量取浓硫酸时,读数时仰视
D容量瓶中有水,未进行干燥
(5)若粗MnO2样品的质量为12.69g,第①步反应后,经过滤得到8.7g MnO2,并收集到0.224L CO2(标准状况下),则在第②步反应中至少需要
考点:物质分离和提纯的方法和基本操作综合应用
专题:
分析:由制备流程可知,MnO2不溶于硫酸,样品中的MnCO3和硫酸反应生成可溶性的MnSO4,滤液中含MnSO4,第②步发生5MnSO4+2NaClO3+4H2O=5MnO2+Cl2↑+Na2SO4+4H2SO4,第③步中发生氯气与热的NaOH发生氧化还原反应生成NaCl、NaClO3、水,溶液蒸发可得到固体.
(1)只有MnO2不与硫酸反应;
(2)结合电子、电荷守恒分析;
(3)蒸发所需的仪器有铁架台(含铁圈)、酒精灯、蒸发皿、玻璃棒;Cl2通入热的NaOH溶液中有NaClO3和NaCl生成;
(4)由于物质的量浓度的计算公式是c=
,操作过程中如果使n值偏大则c偏大,否则偏小;如果使v偏大则c偏小,否则偏大;
(5)根据质量守恒和化学方程式计算,CO2的物质的量为0.01mol,则MnCO3的物质的量为0.01mol,质量为115g/mol×0.01mol=1.15g,所以MnO的质量为3.99g-1.15g=2.84g,其物质的量为
=0.04mol,因此与稀硫酸反应时共生成MnSO4的物质的量为0.05mol,根据方程式5MnSO4+2NaClO3+4H2O=5MnO2+Cl2↑+Na2SO4+4H2SO4,可计算出需要NaClO3的物质的量为0.02mol.
(1)只有MnO2不与硫酸反应;
(2)结合电子、电荷守恒分析;
(3)蒸发所需的仪器有铁架台(含铁圈)、酒精灯、蒸发皿、玻璃棒;Cl2通入热的NaOH溶液中有NaClO3和NaCl生成;
(4)由于物质的量浓度的计算公式是c=
| n |
| v |
(5)根据质量守恒和化学方程式计算,CO2的物质的量为0.01mol,则MnCO3的物质的量为0.01mol,质量为115g/mol×0.01mol=1.15g,所以MnO的质量为3.99g-1.15g=2.84g,其物质的量为
| 2.84g |
| 71g/mol |
解答:
解:由制备流程可知,MnO2不溶于硫酸,样品中的MnCO3和硫酸反应生成可溶性的MnSO4,滤液中含MnSO4,第②步发生5MnSO4+2NaClO3+4H2O=5MnO2+Cl2↑+Na2SO4+4H2SO4,第③步中发生氯气与热的NaOH发生氧化还原反应生成NaCl、NaClO3、水,溶液蒸发可得到固体.
(1)只有MnO2不与硫酸反应,则MnO和MnCO3转化为可溶性物质,故答案为:MnO和MnCO3;
(2)MnSO4要转化为MnO2,需失去电子,故需要加入NaClO3做氧化剂,依据得失电子守恒可以配平,所以反应的化学方程式是:5MnSO4+2NaClO3+4H2O=5MnO2+Cl2↑+Na2SO4+4H2SO4,因此反应的离子方程式是:5Mn2++2ClO3-+4H2O=5MnO2+Cl2↑+8H+,故答案为:5Mn2+;2;4H2O;5;1;8H+;
(3)第③属于蒸发,所以所需的仪器有铁架台(含铁圈)、酒精灯、蒸发皿、玻璃棒;Cl2通入热的NaOH溶液中一定发生氧化还原反应,且氯气既做氧化剂又做还原剂,NaClO3属于氧化产物,因此一定有还原产物NaCl,故答案为:蒸发皿;玻璃棒;NaCl;
(4)A.量筒使用错误,使用量同时不需要洗涤量筒,若洗涤量筒并将洗涤液倒入烧杯,相当多量取硫酸,n值偏高,c偏高,故A正确;
B.定容时仰视液面导致液体的体积偏大,所配制溶液的物质的量浓度偏低,故B错误;
C.用量筒量取浓硫酸时,读数时仰视,导致浓硫酸液体的体积偏大,n值偏高,c偏高,故C正确;
D.容量瓶水洗未干燥,对溶质的物质的量和溶液的体积无影响,所以对配制溶液的物质的量浓度无影响,故D错误;
故选AC;
(5)由题意知样品中的MnO和MnCO3质量为12.69g-8.7 g=3.99g.由方程式H2SO4+MnCO3=MnSO4+H2O+CO2↑可知MnCO3的物质的量为0.01mol,质量为115g/mol×0.01mol=1.15g,所以MnO的质量为3.99g-1.15g=2.84g,其物质的量为
=0.04mol,因此与稀硫酸反应时共生成MnSO4的物质的量为0.05mol,根据方程式5MnSO4+2NaClO3+4H2O=5MnO2+Cl2↑+Na2SO4+4H2SO4,可计算出需要NaClO3的物质的量为0.02mol,故答案为:0.02.
(1)只有MnO2不与硫酸反应,则MnO和MnCO3转化为可溶性物质,故答案为:MnO和MnCO3;
(2)MnSO4要转化为MnO2,需失去电子,故需要加入NaClO3做氧化剂,依据得失电子守恒可以配平,所以反应的化学方程式是:5MnSO4+2NaClO3+4H2O=5MnO2+Cl2↑+Na2SO4+4H2SO4,因此反应的离子方程式是:5Mn2++2ClO3-+4H2O=5MnO2+Cl2↑+8H+,故答案为:5Mn2+;2;4H2O;5;1;8H+;
(3)第③属于蒸发,所以所需的仪器有铁架台(含铁圈)、酒精灯、蒸发皿、玻璃棒;Cl2通入热的NaOH溶液中一定发生氧化还原反应,且氯气既做氧化剂又做还原剂,NaClO3属于氧化产物,因此一定有还原产物NaCl,故答案为:蒸发皿;玻璃棒;NaCl;
(4)A.量筒使用错误,使用量同时不需要洗涤量筒,若洗涤量筒并将洗涤液倒入烧杯,相当多量取硫酸,n值偏高,c偏高,故A正确;
B.定容时仰视液面导致液体的体积偏大,所配制溶液的物质的量浓度偏低,故B错误;
C.用量筒量取浓硫酸时,读数时仰视,导致浓硫酸液体的体积偏大,n值偏高,c偏高,故C正确;
D.容量瓶水洗未干燥,对溶质的物质的量和溶液的体积无影响,所以对配制溶液的物质的量浓度无影响,故D错误;
故选AC;
(5)由题意知样品中的MnO和MnCO3质量为12.69g-8.7 g=3.99g.由方程式H2SO4+MnCO3=MnSO4+H2O+CO2↑可知MnCO3的物质的量为0.01mol,质量为115g/mol×0.01mol=1.15g,所以MnO的质量为3.99g-1.15g=2.84g,其物质的量为
| 2.84g |
| 71g/mol |
点评:本题考查物质制备实验方案的设计,为高频考点,把握流程中发生的化学反应及混合物分离方法为解答的关键,侧重分析能力及推断能力的考查,题目难度不大.

练习册系列答案
相关题目
下列各电离方程式中,书写正确的是( )
| A、CH3COOH?H++CH3COO- |
| B、KHSO4?K++H++SO42- |
| C、Al(OH)3?Al3++3OH- |
| D、NaH2PO4?Na++H2PO42- |
将下列各物质分别按等物质的量混合后加水溶解,有沉淀生成的是( )
| A、Na2CO3,NaAlO2,NaOH |
| B、AlCl3,K2SO4,HCl |
| C、CaCl2,Na2CO3,NaOH |
| D、AlCl3,Ba(OH)2,HNO3 |
下列叙述不正确的是( )
| A、碳酸钙能够溶解在二氧化碳的水溶液中 |
| B、氢氧化镁可溶于盐酸不溶于氯化铵溶液 |
| C、氯化银可溶于氨水 |
| D、硫酸镁溶液中滴加氢氧化钡得到两种沉淀 |
用于净化汽车尾气的反应:2NO(g)+2CO(g)?2CO2(g)+N2(g),已知该反应在570K时几乎完全反应,但反应速率极慢.下列说法正确的是( )
| A、装有尾气净化装置的汽车排出的气体中不再含有NO或CO |
| B、提高尾气净化效率的常用方法是升高温度 |
| C、增大压强,上述平衡右移,故可通过增压的方法提高尾气净化效率 |
| D、提高尾气净化效率的最佳途径是使用高效催化剂 |
有M、N两种溶液,各含有下列12种离子中的6种,且所含离子各不相同:Al3+、Na+、K+、Cl-、NO3-、OH-、Fe3+、Ba2+、H+、SO32-、MnO4-、AlO2-.已知每组溶液中的阳离子至少有2种,则下列说法正确的是( )
| A、若溶液M呈强酸性,则N中一定含有OH-、NO3- |
| B、若溶液N呈强酸性,则N中一定含有Al3+、可能含有Na+ |
| C、若溶液N无色,则N中一定不含有Fe3+、Cl-,且溶液M有强氧化性 |
| D、常温下,若M、N两溶液混合后pH=7,则至少生成三种沉淀 |
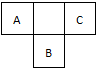 短周期元素的A、B、C,在元素周期表中的位置如图所示,已知A元素单质是空气中含量最多的气体,A、C两种元素的原子核外电子数之和等于B元素的质子数,据此填空:
短周期元素的A、B、C,在元素周期表中的位置如图所示,已知A元素单质是空气中含量最多的气体,A、C两种元素的原子核外电子数之和等于B元素的质子数,据此填空: