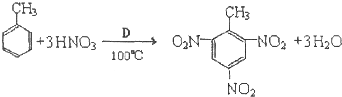
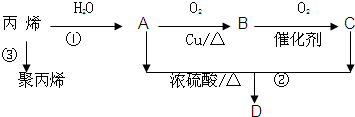
题目内容
2.24g铁和50mL稀HNO3刚好完全反应(HNO3还原产物是NO),向反应后所得溶液加入50mL 0.2mol/L的KI溶液,I-恰好被氧化成单质碘,求原稀HNO3的物质的量浓度?
考点:氧化还原反应的计算
专题:
分析:n(Fe)=
=0.04mol,n(KI)=0.05L×0.2mol/L=0.01mol,可能发生的反应有:Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O,2Fe3++2I-=2Fe2++I2,从质量生成、得失电子守恒的角度结合反应的方程式计算.
| 2.24g |
| 56g/mol |
解答:
解:n(Fe)=
=0.04mol,n(KI)=0.05L×0.2mol/L=0.01mol,
与硝酸可能发生Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O,溶液含有Fe3+,可能Fe2+,加入50mL 0.2mol/L的KI溶液,I-恰好被氧化成单质碘,发生2Fe3++2I-=2Fe2++I2,
则2Fe3++2I-=2Fe2++I2,
2 2
n(Fe3+)0.01mol,
n(Fe3+)=0.01mol,
则硝酸与铁反应生成的Fe2+为(0.04mol-0.01mol)=0.03mol,
由氧化剂、还原剂得失电子守恒可知生成的n(NO)=
=0.03mol,
则n(HNO3)=3n(Fe(NO3)3)+2n(Fe(NO3)2)+n(NO)=3×0.01mol+0.03mol×2+0.03mol=0.12mol,
c(HNO3)=
=2.4mol/L,
答:原稀HNO3的物质的量浓度为2.4mol/L.
| 2.24g |
| 56g/mol |
与硝酸可能发生Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O,溶液含有Fe3+,可能Fe2+,加入50mL 0.2mol/L的KI溶液,I-恰好被氧化成单质碘,发生2Fe3++2I-=2Fe2++I2,
则2Fe3++2I-=2Fe2++I2,
2 2
n(Fe3+)0.01mol,
n(Fe3+)=0.01mol,
则硝酸与铁反应生成的Fe2+为(0.04mol-0.01mol)=0.03mol,
由氧化剂、还原剂得失电子守恒可知生成的n(NO)=
| 0.03mol×2+0.01mol×3 |
| 5-2 |
则n(HNO3)=3n(Fe(NO3)3)+2n(Fe(NO3)2)+n(NO)=3×0.01mol+0.03mol×2+0.03mol=0.12mol,
c(HNO3)=
| 0.12mol |
| 0.05L |
答:原稀HNO3的物质的量浓度为2.4mol/L.
点评:本题考查氧化还原反应以及化学方程式的计算,为高频考点,题目难度中等,本题注意根据质量的变化结合反应的方程式计算,注意从质量守恒的角度分析.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
1molCl2和1molCO2相比较,下列叙述中正确的是( )
| A、分子数相等 | B、原子数相等 |
| C、体积相等 | D、质量相等 |
体积和pH值均相等的A(一元强酸)和B(一元弱酸)两种酸溶液,已知B的电离度为1.3%,则两种酸中和碱的能力相比( )
| A、B是A的1.3倍 |
| B、B是A的76.9倍 |
| C、B是A的98.7倍 |
| D、无法判断 |
化学与生活、社会密切相关.下列说法不正确的是( )
| A、石油裂解、煤的气化、海水的提镁都包含化学变化 |
| B、高温条件下杀死H7N9型禽流感病毒,属于蛋白质的变性 |
| C、纯碱可用于生产普通玻璃,也可用纯碱除去物品表面的油污 |
| D、气候环境报告中“PM2.5”就是雾霾,雾霾仅影响能见度,对人体健康没有影响 |
已知I-、Fe2+、SO2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性强弱顺序为Cl-<Fe2+<H2O2<I-<SO2,则下列反应不能发生的是( )
| A、H2O2+H2SO4=SO2↑+O2↑+2H2O |
| B、2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ |
| C、SO2+I2+2H2O=H2SO4+2HI |
| D、Cl2+SO2+2H2O=H2SO4+2HCl |

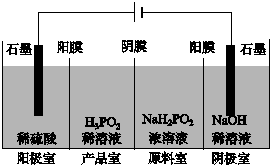 次磷酸(H3PO2)也是一种中强酸,具有强还原性,与足量NaOH反应生成NaH2PO2.H3PO2可用电渗析法制备,“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):
次磷酸(H3PO2)也是一种中强酸,具有强还原性,与足量NaOH反应生成NaH2PO2.H3PO2可用电渗析法制备,“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):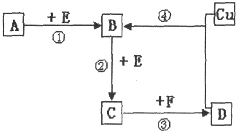 A、B、C、D、F是常见的化合物,其中F在常温下是一种无色液体,D为强酸,请根据如图转化关系(反应条件及部分产物已略去),回答下列问题:
A、B、C、D、F是常见的化合物,其中F在常温下是一种无色液体,D为强酸,请根据如图转化关系(反应条件及部分产物已略去),回答下列问题: