题目内容
4.下列物质在常温下可用铝或铁的容器贮存的是( )| A. | 浓硫酸 | B. | 稀硝酸 | C. | 王水 | D. | 硫酸铜 |
分析 常温下,铝或铁易和浓硫酸、浓硝酸发生钝化现象而阻止进一步反应,据此分析解答.
解答 解:A、浓硫酸有强氧化性,能把铝或铁的表面氧化成致密的氧化物薄膜,这层薄膜阻止了酸与内层金属的进一步的反应,故A正确;
B、铝或铁能和稀硝酸反应生成NO气体,故B错误;
C、王水为盐酸和硝酸的混合物,能溶解铝或铁,故C错误;
D、硫酸铜能和铝或铁发生置换反应,故D错误;
故选A.
点评 本题考查了铁、铝的化学性质,铁、铝都能和浓硫酸、浓硝酸在常温下发生钝化现象,所以可用铁、铝制容器盛放浓硫酸、浓硝酸.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.分枝酸可用于生化研究,其结构简式如图.下列关于分枝酸的叙述正确的是( )
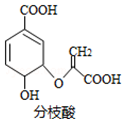

| A. | 分子中含有5种官能团 | |
| B. | 可与乙醇、乙酸反应,且反应类型相同 | |
| C. | 1mol分枝酸最多可与3molNaOH发生中和反应 | |
| D. | 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且反应类型相同 |
6.根据下列实验“操作和现象”,得出的结论正确的是( )
)
)
| 选项 | 操作和现象 | 结论 |
| A | 将表面附有黑色Ag2S的银器浸入盛有食盐水的铝质容器中,黑色逐渐褪去 | 银器为正极,Ag2S得电子生成单质银 |
| B | 测定相同浓度的Na2SO3与Na2CO3溶液的pH,后者较大 | 非金属性:S>C |
| C | 向NaAlO2溶液中滴入NaHCO3溶液,有白色沉淀生成 | AlO2-和HCO3-的水解反应相互促进 |
| D | 将Fe(NO3)2晶体溶于稀H2SO4后,滴加KSCN溶液,溶液变红 | Fe(NO3)2晶体已氧化变质 |
| A. | A | B. | B | C. | C | D. | D |
12.酸雨是指( )
| A. | pH<7的雨水 | B. | pH<5.6的雨水 | C. | pH=5.6的雨水 | D. | pH>7的雨水 |
19.下列叙述正确的是( )
| A. | 可能存在核外电子排布式为1s22s22p63s23p64s24p1的原子 | |
| B. | 当电子排布在同一能级的不同轨道时,总是优先单独占据一个轨道,而且自旋方向相反 | |
| C. | 次氯酸的电子式:H?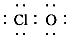 | |
| D. | 基态原子的电子获得一定能量变为激发态原子,而激发态原子变为基态原子,则要放出能量 |
9.15LNO2通过水后(未完全反应)收集到7L气体(同温同压),则被氧化的NO2有( )
| A. | 4L | B. | 6L | C. | 8L | D. | 12L |
16.设NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A. | 11.2L氧气所含的原子数为NA | |
| B. | 2.3g金属钠变为钠离子得到0.1NA电子 | |
| C. | 0.5mol/LH2SO4中的H+数为NA | |
| D. | 常温常压下32g O2与O3的混合物含有的氧原子数为2NA |
13.向Fe2O3、CuO、Fe、Cu的混和粉未中加入过量的稀硫酸,充分反应后,仍有红色粉未存在,则关于溶液中阳离子的判断正确的是( )
| A. | 只有Fe2+和Cu2+ | B. | 一定有Fe2+、Cu2+,可能有Fe3+ | ||
| C. | 一定有Fe2+,可能有Cu2+ | D. | 只有Fe2+ |
14.下列解释事实的化学(或离子)方程式正确的是( )
| A. | 向100ml浓度均为1mol/LFeI2、FeBr2混合溶液中通入标况下4.48L的氯气:3Cl2+2Fe2++4I-=2I2+2Fe3++6Cl- | |
| B. | 将1 mol•L-1 NaAlO2溶液和1.5 mol•L-1的HC1溶液等体积混合:6AlO2-+9H++3H2O═5Al(OH)3↓+Al3+ | |
| C. | 在澄清石灰水中加入过量的Ca(HCO3)2溶液:2OH-+Ca2++2HCO3-═CaCO3↓+CO32-+2H2O | |
| D. | 向NaClO溶液加入少量FeCl2溶液:2Fe2++ClO-+2H+═2Fe3++2H2O+Cl- |