题目内容
10.根据下列数据计算元素X的摩尔质量:(1)标准状况下,气态单质Xn的密度是dg•L-1,则X的摩尔质量为22.4dg•mol-1.
(2)相同条件下,一定体积X的气态氢化物HmX质量是等体积NH3的2倍,则X的摩尔质量为34-mg•mol-1
(3)a个X原子的总质量为bg,设NA表示阿伏加德罗常数,则X的摩尔质量为$\frac{b×{N}_{A}}{a}$g•mol-1.
分析 (1)标准状况下,M=ρVm;
(2)体积比等于物质的量比,结合m=nM计算;
(3)结合n=$\frac{N}{{N}_{A}}$=$\frac{m}{M}$计算.
解答 解:(1)标准状况下,气态单质Xn的密度是dg•L-1,则X的摩尔质量为dg•L-1×22.4L/mol=22.4dg/mol,故答案为:22.4d;
(2)体积比等于物质的量比,则M=2×17g/mol=34g/mol,X的摩尔质量为(34-m)g/mol,故答案为:34-m;
(3)a个X原子的总质量为bg,设NA表示阿伏加德罗常数,由n=$\frac{N}{{N}_{A}}$=$\frac{m}{M}$,则X的摩尔质量为$\frac{b×{N}_{A}}{a}$g/mol,故答案为:$\frac{b×{N}_{A}}{a}$.
点评 本题考查物质的量的计算,为高频考点,把握质量、物质的量、微粒个数为解答的关键,侧重分析与计算能力的考查,注意基本计算公式的应用,题目难度不大.

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目
20.将质量为m g的铁片放入CuSO4溶液中,过一会儿取出干燥、称量,铁片质量变为n g,被氧化的铁片质量是( )
| A. | 8(m-n)g | B. | 8(n-m)g | C. | 7(n-m)g | D. | 7(m-n)g |
18.关于如图所示装置的叙述,正确的是( )
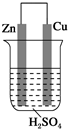

| A. | 铜极质量逐渐减少 | B. | 锌是正极,发生氧化反应 | ||
| C. | 电流从锌片经导线流向铜片 | D. | 阳离子向铜极移动 |
15.如图所示的装置中,a、b都是惰性电极,通电一段时间后,b电极附近溶液呈红色.下列说法中正确的是( )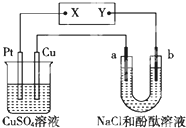

| A. | X是正极,Y是负极 | |
| B. | NaCl溶液中的Cl-移向b极 | |
| C. | CuSO4溶液的pH不变 | |
| D. | 理论上,a和b生成的气体的物质的量之比为1:2 |
3.在2000K时,反应CO(g)+$\frac{1}{2}$O2(g)?CO2(g)的平衡常数为K,则相同温度下反应2CO2(g)?2CO(g)+O2(g)的平衡常数为( )
| A. | $\frac{1}{K}$ | B. | K2 | C. | ($\frac{1}{K}$)2 | D. | $(K)^{-\frac{1}{2}}$ |

 用0.1000mol•L-1NaOH溶液滴定20.00mL某未知浓度的醋酸溶液,滴定曲线如图所示.其中①点所示溶液中c(CH3COO-)=2c(CH3COOH),则CH3COOH的电离平衡常数Ka=2×10-5mol/L.
用0.1000mol•L-1NaOH溶液滴定20.00mL某未知浓度的醋酸溶液,滴定曲线如图所示.其中①点所示溶液中c(CH3COO-)=2c(CH3COOH),则CH3COOH的电离平衡常数Ka=2×10-5mol/L.