题目内容
20.将质量为m g的铁片放入CuSO4溶液中,过一会儿取出干燥、称量,铁片质量变为n g,被氧化的铁片质量是( )| A. | 8(m-n)g | B. | 8(n-m)g | C. | 7(n-m)g | D. | 7(m-n)g |
分析 发生Fe+CuSO4=FeSO4+Cu,ng为Fe、Cu的混合物,参加反应的Fe失去电子被氧化,结合差量法计算.
解答 解:设被氧化的铁片质量是为x,则
Fe+CuSO4=FeSO4+Cu△m
56 64 8
x (n-m)g
$\frac{56}{x}=\frac{8}{(n-m)g}$,
解得x=7(n-m)g,
故选C.
点评 本题考查化学反应方程式的计算,为高频考点,把握发生的反应、固体质量变化为解答的关键,侧重分析与计算能力的考查,注意差量法在计算中的应用,题目难度不大.

练习册系列答案
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案
相关题目
8.下列不属于抑酸剂的主要成分的是( )
| A. | 氧化镁 | B. | 氢氧化铜 | C. | 氢氧化铝 | D. | 小苏打 |
15. 阅读、分析下列材料:
阅读、分析下列材料:
材料一:如图
材料二:
根据上述材料回答下列问题(填写序号):
A、蒸馏法 B、萃取法 C、结晶法 D、分液法
(1)将纯碱从氯化钠和纯碱的混合物中分离出来的最佳方法是C.
(2)将乙二醇和丙三醇相互分离的最佳方法是A.
(3)分离汽油和水的最佳方法是D.
(4)从海水中提取单质碘的最佳方法是B.
 阅读、分析下列材料:
阅读、分析下列材料:材料一:如图
材料二:
| 物 质 | 熔 点℃ | 沸 点℃ | 密度 g•cm-3 | 溶解性 |
| 乙二醇(C2H6O2) | -11.5 | 198 | 1.11 | 易溶于水 和乙醇 |
| 丙三醇(C3H8O3) | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比互溶 |
A、蒸馏法 B、萃取法 C、结晶法 D、分液法
(1)将纯碱从氯化钠和纯碱的混合物中分离出来的最佳方法是C.
(2)将乙二醇和丙三醇相互分离的最佳方法是A.
(3)分离汽油和水的最佳方法是D.
(4)从海水中提取单质碘的最佳方法是B.
12.为了除去镀在铝表面的铜镀层,可选用的试剂是( )
| A. | 稀硝酸 | B. | 盐酸 | C. | 稀硫酸 | D. | 浓硝酸 |
9.下列过程属吸热过程的是( )
| A. | 镁与盐酸反应放出氢气 | B. | 氢氧化钠与盐酸的反应 | ||
| C. | 浓硫酸与蔗糖混合 | D. | Ba(OH)2•8H2O与NH4Cl反应 |

 +Cl2$\stackrel{光照}{→}$
+Cl2$\stackrel{光照}{→}$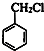 +HCl.
+HCl. 不能发生的化学反应是b(填序号).
不能发生的化学反应是b(填序号). (写出一种即可).
(写出一种即可). .
.