题目内容
4.尿黑酸症是由酪氨酸在人体内非正常代谢而产生的一种疾病.其转化过程如下: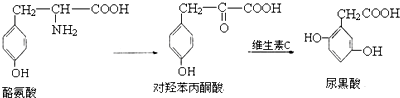
下列说法错误的是( )
| A. | 1mol酪氨酸能与含1molHCl的盐酸反应,又能与含2molNaOH的溶液反应 | |
| B. | 酪氨酸能发生加成、取代、消去和缩聚反应 | |
| C. | 1mol对羟苯丙酮酸最多可与5molH2反应 | |
| D. | 1mol尿黑酸最多可与3molBr2反应 |
分析 A.酪氨酸中含有氨基、羧基和酚羟基,具有氨基酸和酚的性质;
B.酪氨酸中含有氨基、羧基和酚羟基、苯环,具有氨基酸和酚、苯的性质,能发生加成反应、取代反应、缩聚反应;
C.对羟苯丙酮酸中苯环和羰基能和氢气在一定条件下发生加成反应;
D.尿黑酸中苯环上酚羟基邻对位氢原子能和溴发生取代反应.
解答 解:A.酪氨酸中含有氨基、羧基和酚羟基,具有氨基酸和酚的性质,1mol酪氨酸能与含1molHCl的盐酸反应,又能与含2molNaOH的溶液反应,故A正确;
B.酪氨酸中含有氨基、羧基和酚羟基、苯环,具有氨基酸和酚、苯的性质,能发生加成反应、取代反应、缩聚反应,但不能发生消去反应,故B错误;
C.对羟苯丙酮酸中苯环和羰基能和氢气在一定条件下发生加成反应,1mol对羟苯丙酮酸最多可与4molH2反应,故C错误;
D.尿黑酸中苯环上酚羟基邻对位氢原子能和溴发生取代反应,所以1mol尿黑酸最多可与3molBr2反应,故D正确;
故选BC.
点评 本题考查有机物结构和性质,为高频考点,侧重考查学生分析判断能力,明确官能团及其性质关系是解本题关键,侧重考查酚、氨基酸、酮及苯的性质,题目难度不大.

练习册系列答案
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案
相关题目
14.下列热化学方程式中,正确的是( )
| A. | 甲烷的燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 101 kPa时,2 g H2完全燃烧生成液态水放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJ•mol-1 | |
| C. | HCl和NaOH反应的中和热△H=-57.3 kJ•mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ•mol-1 | |
| D. | 500℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g)放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ•mol-1 |
15.当光束通过下列散系时,能产生丁达尔现象的是( )
| A. | Al(OH)3胶体 | B. | 氯化钠溶液 | C. | 盐酸 | D. | 硫酸 |
12.常温下,下列有关说法正确的是( )
| A. | 0.1 mol/L的Na2S溶液:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| B. | pH=11的氨水与pH=3的硫酸各1L混合后,C(NH4+)>2c(SO42-) | |
| C. | pH=11的氨水与pH=11的醋酸钠溶液,由水电离出的c(H+)相等 | |
| D. | pH相同的①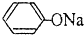 溶液②CH3COONa溶液中的c(Na+):①>② 溶液②CH3COONa溶液中的c(Na+):①>② |
19.下列各种关于酸的使用,其中正确的是( )
| A. | 检验氯乙烷中的氯元素,水解后再用硫酸酸化 | |
| B. | 为了增强KMnO4溶液的氧化能力,用浓盐酸酸化 | |
| C. | 为了抑制Fe2+的水解,用稀硝酸酸化 | |
| D. | 检验溶液中是否含有SO42-时,先用盐酸酸化 |
9.下列叙述正确的是( )
| A. | NaOH可用于治疗胃酸过多 | |
| B. | CaO可防止月饼等食品氧化变质 | |
| C. | 氢弹中用到的2H、3H互为同位素 | |
| D. | 向海水中加入净水剂明矾可以使海水淡化 |
16.Na2SO3应用广泛.利用工业废碱渣(主要成分Na2CO3)吸收硫酸厂尾气中的SO2制备无水Na2SO3的成本低,优势明显,其流程如下.
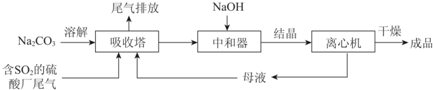
(1)举例说明向大气中排放SO2导致的环境问题:酸雨.
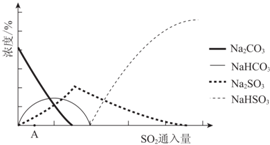
(2)图为吸收塔中Na2CO3溶液与SO2反应过程中溶液组成变化.则初期反应(图中A点以前)的离子方程式是2CO32-+SO2+H2O=2HCO3-+SO32-.
(3)中和器中发生的主要反应的化学方程式是NaHSO3+NaOH=Na2SO3+H2O.
(4)为了降低由中和器所得溶液中Na2SO3的溶解度,从而提高结晶产率,中和器中加入的NaOH是过量的.
①请结合Na2SO3的溶解平衡解释NaOH过量的原因Na2SO3存在溶解平衡:Na2SO3(s) 2Na+ (aq)+SO32- (aq),NaOH过量使c(Na+)增大,上述平衡逆向移动.
2Na+ (aq)+SO32- (aq),NaOH过量使c(Na+)增大,上述平衡逆向移动.
②结晶时应选择的最佳操作是b(选填字母).
a.95~100℃加热蒸发,直至蒸干
b.维持95~100℃蒸发浓缩至有大量晶体析出
c.95~100℃加热浓缩,冷却至室温结晶
(5)为检验Na2SO3成品中是否含少量Na2SO4,需选用的试剂是稀盐酸、BaCl2溶液.
(6)KIO3滴定法可测定成品中Na2SO3的含量:室温下将0.1260g 成品溶于水并加入淀粉做指示剂,再用酸性KIO3标准溶液(x mol/L)进行滴定至溶液恰好由无色变为蓝色,消耗KIO3标准溶液体积为y mL.
①滴定终点前反应的离子方程式是:1IO3-+3SO32-=3SO42-+1I-(将方程式补充完整)
②成品中Na2SO3(M=126g/mol)的质量分数是3xy×100%.

(1)举例说明向大气中排放SO2导致的环境问题:酸雨.
(2)图为吸收塔中Na2CO3溶液与SO2反应过程中溶液组成变化.则初期反应(图中A点以前)的离子方程式是2CO32-+SO2+H2O=2HCO3-+SO32-.

(3)中和器中发生的主要反应的化学方程式是NaHSO3+NaOH=Na2SO3+H2O.
| 资料显示: Ⅰ.Na2SO3在33℃时溶解度最大,将其饱和溶液加热至33℃以上时,由于溶解度降低会析出无水Na2SO3,冷却至33℃以下时析出Na2SO3•7H2O; Ⅱ.无水Na2SO3在空气中不易被氧化,Na2SO3•7H2O在空气中易被氧化. |
①请结合Na2SO3的溶解平衡解释NaOH过量的原因Na2SO3存在溶解平衡:Na2SO3(s)
 2Na+ (aq)+SO32- (aq),NaOH过量使c(Na+)增大,上述平衡逆向移动.
2Na+ (aq)+SO32- (aq),NaOH过量使c(Na+)增大,上述平衡逆向移动.②结晶时应选择的最佳操作是b(选填字母).
a.95~100℃加热蒸发,直至蒸干
b.维持95~100℃蒸发浓缩至有大量晶体析出
c.95~100℃加热浓缩,冷却至室温结晶
(5)为检验Na2SO3成品中是否含少量Na2SO4,需选用的试剂是稀盐酸、BaCl2溶液.
(6)KIO3滴定法可测定成品中Na2SO3的含量:室温下将0.1260g 成品溶于水并加入淀粉做指示剂,再用酸性KIO3标准溶液(x mol/L)进行滴定至溶液恰好由无色变为蓝色,消耗KIO3标准溶液体积为y mL.
①滴定终点前反应的离子方程式是:1IO3-+3SO32-=3SO42-+1I-(将方程式补充完整)
②成品中Na2SO3(M=126g/mol)的质量分数是3xy×100%.
13.下列物质中,属于纯净物的是( )
| A. | 水泥 | B. | 漂白粉 | C. | 胆矾 | D. | 氯水 |
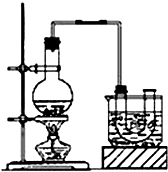 已知:CH3CH2OH+NaBr+H2SO4(浓)$\stackrel{△}{→}$ CH3CH2Br+NaHSO4+H2O.
已知:CH3CH2OH+NaBr+H2SO4(浓)$\stackrel{△}{→}$ CH3CH2Br+NaHSO4+H2O.