题目内容
14.下列热化学方程式中,正确的是( )| A. | 甲烷的燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 101 kPa时,2 g H2完全燃烧生成液态水放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJ•mol-1 | |
| C. | HCl和NaOH反应的中和热△H=-57.3 kJ•mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ•mol-1 | |
| D. | 500℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g)放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ•mol-1 |
分析 A.燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量分析;
B.依据热化学方程式的书写方法写出,注意物质聚集状态和反应的焓变;
C.中和热是指在稀溶液中,强酸和强碱反应生成1mol水时放出的热量;
D.0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,生成的氨气的物质的量小于1mol,相同条件下的同一可逆反应,正逆反应反应热数值相等,符号相反.
解答 解:A.根据燃烧热的概念:1mol可燃物完全燃烧生成稳定的氧化物,所放出的热量为燃烧热,水的状态应该为液态,故A错误;
B.注意物质聚集状态和反应的焓变,在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l);△H=-571.6kJ/mol,故B正确;
C.中和热是指在稀溶液中,强酸和强碱反应生成1mol水时放出的热量,其衡量标准是生成的水为1mol,故无论稀H2SO4和Ca(OH)2反应生成的水是几摩尔,其中和热恒为-57.3KJ/mol,故C错误;
D.相同条件下的同一可逆反应,正逆反应反应热数值相等,符号相反,0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,生成的氨气的物质的量小于1mol,所以2mol氨气分解,吸收的热量大于38.6kJ,故D错误;
故选:B.
点评 本题考查了热化学方程式的书写方法,明确燃烧热、中和热的概念是解题关键,注意可逆反应不能进行到底,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
5.下列实验操作说法正确的是( )
| 选项 | 实验操作 | 现象与结论(或装置用途) |
| A | 2mL 2% CuSO4中加4~6滴2% NaOH溶液,振荡后加入0.5mL X溶液,加热煮沸 | 未出现砖红色沉淀,说明X不含有醛基 |
| B |  | 可以用于比较Fe3+、I2、Cl2的氧化性强弱 |
| C | 某溶液加入浓NaOH溶液加热,在试管口放一片湿润的红色石蕊试纸中 | 试纸变蓝,说明NH3溶于水显碱性 |
| D |  | 用图所示装置分离沸点相差较大的互溶液体混合物 |
| A. | A | B. | B | C. | C | D. | D |
9.Na2S溶液中存在多种微粒,下列各微粒间的关系正确的是( )
| A. | c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+) | B. | c(Na+)+c(H+)═c(S2-)+c(HS-)+c(OH-) | ||
| C. | c(Na+)═c(HS-)+2c(H2S)+2c(S2-) | D. | c(OH-)═c(H+)+c(HS-)+c(H2S) |
6.元素周期表中同一主族的两种元素原子序数之差不可能是( )
| A. | 16 | B. | 26 | C. | 46 | D. | 50 |
3.“司乐平”是治疗高血压的一种临床药物,其有效成分M的结构简式如图.下列关于M的说法正确的是( )
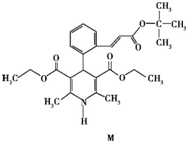

| A. | 属于芳香烃 | B. | 遇FeCl3溶液显紫色 | ||
| C. | 能使酸性高锰酸钾溶液褪色 | D. | 1 mol M完全水解生成2 mol醇 |
4.尿黑酸症是由酪氨酸在人体内非正常代谢而产生的一种疾病.其转化过程如下:
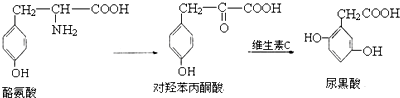
下列说法错误的是( )

下列说法错误的是( )
| A. | 1mol酪氨酸能与含1molHCl的盐酸反应,又能与含2molNaOH的溶液反应 | |
| B. | 酪氨酸能发生加成、取代、消去和缩聚反应 | |
| C. | 1mol对羟苯丙酮酸最多可与5molH2反应 | |
| D. | 1mol尿黑酸最多可与3molBr2反应 |
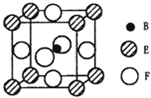 A、B、C、D、E、F六种元素的原子序数依次增大.A的最高正价和最低负价的绝对值相等.B的基态原子有3个不同的能级且各能级中电子数相等.D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子的s能级的电子总数与p能级的电子数相等,F的基态原子的3d轨道电子数是4s电子数的4倍.请回答下列问题:
A、B、C、D、E、F六种元素的原子序数依次增大.A的最高正价和最低负价的绝对值相等.B的基态原子有3个不同的能级且各能级中电子数相等.D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子的s能级的电子总数与p能级的电子数相等,F的基态原子的3d轨道电子数是4s电子数的4倍.请回答下列问题: