题目内容
13.已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测其离子浓度大小顺序有如下四种关系:①c(Cl-)>c(NH4+)>c(H+)>c(OH-)
②c(NH4+)>c(OH-)>c(Cl-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+)
④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
填写下列空白:
(1)若溶液中溶解了一种溶质,则该溶液是NH4Cl(用化学式表示).上述四种离子浓度的大小吮吸为①(填序号).
(2)若上述关系④是正确的,则溶液中的溶质为NH4Cl,HCl(用化学式表示);
(3)若该溶液是由体积相等的HCl溶液和氨水混合而成,且恰好呈中性,则混合前c(HCl)<c(NH3•H2O),混合前酸中c(H+)和碱中c(OH-)的关系c(H+)>c(OH-)(填“>”、“<”或“=”)
分析 (1)任何水溶液中都有OH-、H+,若溶质只有一种则为NH4Cl,利用铵根离子水解使溶液显酸性来分析;
(2)由④中的离子关系可知溶液显酸性,且c(Cl-)>c(H+)>c(NH4+),则溶液为盐酸与氯化铵的混合溶液;
(3)体积相等稀盐酸和氨水混合,若浓度相等,则恰好完全反应生成氯化铵,溶液显酸性,则溶液恰好呈中性时应为氨水与氯化铵的混合溶液来分析;酸完全电离,碱部分电离.
解答 解:(1)因任何水溶液中都有OH-、H+,若溶质只有一种则为NH4Cl,铵根离子水解方程式为NH4++H2O?NH3.H2O+H+,则c(Cl-)>c(NH4+),水解显酸性,则c(H+)>c(OH-),又水解的程度很弱,则c(Cl-)>c(NH4+)>c(H+)>c(OH-),即①符合,
故答案为:NH4Cl;①;
(2)④中的离子关系可知溶液显酸性,且c(Cl-)>c(H+)>c(NH4+),则溶液为盐酸与氯化铵的混合溶液,其溶质为HCl、NH4Cl,
故答案为:NH4Cl和HCl;
(3)因体积、浓度相同的稀盐酸和氨水混合,溶液中的溶质为氯化铵,溶液显酸性,而该溶液恰好呈中性,则应为氨水与氯化铵的混合溶液,即c(HCl)<c(NH3•H2O),HCl为强电解质,完全电离,NH3.H2O为弱电解质,不完全电离,则混合前酸中c(H+)和碱中c(OH-)的关系为c(H+)>c(OH-);
故答案为:<;>.
点评 本题考查了盐的水解原理和弱电解质的电离,注意利用离子的关系来分析溶液中的溶质,明确溶液中的电离和水解是解答本题的关键,并注意(3)是学生解答的难点,题目难度中等.

练习册系列答案
相关题目
4.已知向NaNO2溶液中加入酸性KMnO4溶液发生如下反应:2KMnO4+5NaNO2+3H2SO4═2MnSO4+5NaNO3+K2SO4+3H2O有关该反应的下列说法中正确的是( )
| A. | KMnO4作氧化剂 | |
| B. | 该反应不属于离子反应 | |
| C. | 氮元素被还原 | |
| D. | 当生成lmol MnSO4时,转移10 mol电子 |
1.下列说法正确的是( )
| A. | SiO2(s)+2C(s)═Si(s)+2CO(g)在常温下不能自发进行,则该反应的△H>0 | |
| B. | 一定条件下,将0.5mol N2(g)和1.5molH2(g)置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | C(s)+H2O(g)?CO(g)+H2(g)(△H>0),其它条件不变时,升高温度,正反应速率增大、逆反应速率减小,平衡正向移动 | |
| D. | CO(g)的燃烧热是283.0 kJ•mol-1,则CO2分解的热化学方程式为:2CO2(g)═2CO(g)+O2(g)△H=+283.0 kJ•mol-1 |
8.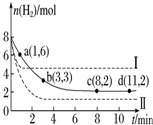 将6mol CO2和8mol H2充入一容积为2L的密闭容器中(温度保持不变)发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0测得H2的物质的量随时间变化如右图中实线所示(图中字母后的数字表示对应的坐标).该反应在8~10min内CO2的平均反应速率是( )
将6mol CO2和8mol H2充入一容积为2L的密闭容器中(温度保持不变)发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0测得H2的物质的量随时间变化如右图中实线所示(图中字母后的数字表示对应的坐标).该反应在8~10min内CO2的平均反应速率是( )
 将6mol CO2和8mol H2充入一容积为2L的密闭容器中(温度保持不变)发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0测得H2的物质的量随时间变化如右图中实线所示(图中字母后的数字表示对应的坐标).该反应在8~10min内CO2的平均反应速率是( )
将6mol CO2和8mol H2充入一容积为2L的密闭容器中(温度保持不变)发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0测得H2的物质的量随时间变化如右图中实线所示(图中字母后的数字表示对应的坐标).该反应在8~10min内CO2的平均反应速率是( )| A. | 0.5mol•L-1•min-1. | B. | 0.1mol•L-1•min-1 | ||
| C. | 0 mol•L-1•min-1 | D. | 0.125mol•L-1•min-1 |
18.某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变成H2、CO.其过程如图:下列说法不正确的是( )


| A. | 该过程中CeO2做催化剂 | |
| B. | 该过程实现了太阳能与化学能的相互转化 | |
| C. | 图中△H1+△H2+△H3﹦0 | |
| D. | 以CO和O2构成的碱性燃料电池的负极反应式为:CO+4OH--2e-═CO32-+2H2O |
5.下列各项操作中,不发生“先产生沉淀,后沉淀溶解”现象的是( )
①向硅酸钠溶液中通入过量的CO2②向Fe(OH)3胶体中逐滴加入过量的稀盐酸
③向NaAlO2溶液中通入过量的CO2 ④向澄清石灰水中通入缓慢过量的CO2.
①向硅酸钠溶液中通入过量的CO2②向Fe(OH)3胶体中逐滴加入过量的稀盐酸
③向NaAlO2溶液中通入过量的CO2 ④向澄清石灰水中通入缓慢过量的CO2.
| A. | ①② | B. | ①③ | C. | ①④ | D. | ②③ |
2.下列物质的体积约为22.4L的是( )
| A. | 标准状况下1molH2O | |
| B. | 20℃、101kPa时36.5gHCl | |
| C. | 常温常压下17gNH3 | |
| D. | 标准状况下0.4mol H2和0.6molO2的混合气 |

