题目内容
3.Fe跟Cl2在一定条件下反应,将产物溶于水配成溶液,分装在两支试管中.请回答:①若向其中一支试管中滴加KSCN溶液,则溶液变成血红色.
②向另一支试管中滴加NaOH溶液,反应的离子方程式是Fe3++3OH-═Fe(OH)3↓.
分析 铁与氯气反应生成氯化铁,
①铁离子与SCN-反应生成Fe(SCN)3,溶液呈红色;
②氯化铁与氢氧化钠反应生成氢氧化铁与氯化钠,氢氧化铁是红褐色沉淀.
解答 解:①铁与氯气反应生成氯化铁;铁离子与SCN-反应生成Fe(SCN)3,溶液呈红色,
故答案为:血红;
②氯化铁与氢氧化钠反应生成氢氧化铁与氯化钠,现象为:生成红褐色沉淀,反应离子方程式为:Fe3++3OH-═Fe(OH)3↓,
故答案为:Fe3++3OH-═Fe(OH)3↓.
点评 本题考查了铁及其化合物性质,题目难度不大,明确铁及其化合物性质为解答关键,注意掌握铁离子的检验方法,试题侧重基础知识的考查,培养了学生的灵活应用能力.

练习册系列答案
相关题目
13.(1)键线式 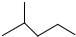 表示的分子式结构简式名称是C6H14、(CH3)2CHCH2CH2CH3、2-甲基戊烷.
表示的分子式结构简式名称是C6H14、(CH3)2CHCH2CH2CH3、2-甲基戊烷.
(2)含有杂质的工业乙醇的蒸馏装置中,玻璃仪器有酒精灯、蒸馏烧瓶、冷凝管、尾接管、锥形瓶.
(3)为研究某有机物A的组成与结构,进行了如下实验:
 表示的分子式结构简式名称是C6H14、(CH3)2CHCH2CH2CH3、2-甲基戊烷.
表示的分子式结构简式名称是C6H14、(CH3)2CHCH2CH2CH3、2-甲基戊烷.(2)含有杂质的工业乙醇的蒸馏装置中,玻璃仪器有酒精灯、蒸馏烧瓶、冷凝管、尾接管、锥形瓶.
(3)为研究某有机物A的组成与结构,进行了如下实验:
| 实验步骤 | 解释或实验结论 |
| (1)称取A物质 18.0g,升温使其汽化,测其密度是相同条件下H2的45倍. | 试通过计算填空: ?A的相对分子质量为:90 |
(2)A的核磁共振氢谱如图: | ?A中含有4种氢原子 |
18.按照物质的树状分类和交叉分类,HNO3应属于A( )
①酸
②氧化物
③含氧酸
④一元酸
⑤电解质
⑥混合物
⑦无机化合物.
①酸
②氧化物
③含氧酸
④一元酸
⑤电解质
⑥混合物
⑦无机化合物.
| A. | ①②③④⑤⑦ | B. | ①④⑥⑦ | C. | ①②③④⑥ | D. | ①③④⑤⑦ |
8.下列气态氢化物中,最稳定的是( )
| A. | H2O | B. | HF | C. | NH3 | D. | PH3 |
15.与 NH4+ 离子所含电子总数和质子总数相同的粒子是( )
| A. | Ne | B. | F- | C. | Na+ | D. | K+ |
12.下列关于海水资源综合利用的说法中,正确的是( )
| A. | 海水蒸发制海盐的过程只发生化学变化 | |
| B. | 只通过物理变化即可从海水中提取溴单质 | |
| C. | 从海水中可以得到MgCl2,可电解MgCl2溶液制备Mg | |
| D. | 海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等 |
13.下列物质中,既能与稀盐酸反应,又能与氢氧化钠溶液反应的是( )
| A. | CuO | B. | SiO2 | C. | Al2O3 | D. | MgO |
 .
.