题目内容
【化学------选修物质结构与性质】
五种短周期元素甲、乙、丙、丁、戊的原子序数依次增大,甲和丙同族,乙离子和丙离子具有相同的电子层结构.甲和乙、丁、戊均能形成共价型化合物.甲和乙形成的化合物在水中呈碱性,单质丁在单质戊中可燃烧产生白色烟雾.回答下列问题:
(1)五种元素中,原子半径最大的是 ,非金属性最强的是 ;(填元素符号);
(2)由甲和乙、丁、戊所形成的共价型化合物中,热稳定性最差的是 ;(用化学式表示);
(3)甲和乙形成的化合物的中心原子的杂化类型为 ;甲和乙形成的化合物可与甲和戊形成的化合物反应,其产物中存在的化学键类型为 ;
(4)除乙外,上述元素的电负性从大到小依次为 ;(填元素符号);
(5)单质戊与水反应的离子方程式为 ;
(6)一定条件下1.86g单质丁与2.912L单质戊(标准状况)反应,则产物为 ,(用化学式表示)其物质的量之比为 .
五种短周期元素甲、乙、丙、丁、戊的原子序数依次增大,甲和丙同族,乙离子和丙离子具有相同的电子层结构.甲和乙、丁、戊均能形成共价型化合物.甲和乙形成的化合物在水中呈碱性,单质丁在单质戊中可燃烧产生白色烟雾.回答下列问题:
(1)五种元素中,原子半径最大的是
(2)由甲和乙、丁、戊所形成的共价型化合物中,热稳定性最差的是
(3)甲和乙形成的化合物的中心原子的杂化类型为
(4)除乙外,上述元素的电负性从大到小依次为
(5)单质戊与水反应的离子方程式为
(6)一定条件下1.86g单质丁与2.912L单质戊(标准状况)反应,则产物为
考点:离子键的形成,元素电离能、电负性的含义及应用
专题:化学键与晶体结构
分析:五种短周期元素甲、乙、丙、丁、戊的原子序数依次增大.甲和乙形成的化合物在水中呈碱性,该化合物为NH3,则甲为氢元素、乙为氮元素;甲和丙同族,乙离子和丙离子具有相同的电子层结构,则丙为Na元素;甲和乙、丁、戊均能形成共价型化合物,单质丁在单质戊中可燃烧产生白色烟雾.则丁为磷元素,戊为氯元素,据此解答.
解答:
解:五种短周期元素甲、乙、丙、丁、戊的原子序数依次增大.甲和乙形成的化合物在水中呈碱性,该化合物为NH3,则甲为氢元素、乙为氮元素;甲和丙同族,乙离子和丙离子具有相同的电子层结构,则丙为Na元素;甲和乙、丁、戊均能形成共价型化合物,单质丁在单质戊中可燃烧产生白色烟雾.则丁为磷元素,戊为氯元素,
(1)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故Na元素的原子半径最大;
最高价含氧酸的酸性越强,中心元素的非金属性越强,高氯酸是最强的含氧酸,故Cl非金属性最强;
故答案为:Na;Cl;
(2)由A和B、D、E所形成的共价型化合物分别为NH3、PH3、HCl,非金属性越强氢化物越稳定,故热稳定性最差的是 PH3,
故答案为:PH3;
(3)甲和乙形成的化合物NH3,价层电子对个数是3+
(5-1×3)=4,其含有一个孤电子对,所以其中心原子杂化类型为sp3,NH3h和HCl二者反应生成NH4Cl,NH4Cl晶体中含有:离子键、共价键,
故答案为:sp3;离子键、共价键;
(4)一般来说,周期表从左到右,元素的电负性逐渐变大;周期表从上到下,元素的电负性逐渐变小.电负性大得元素集中在元素周期表的右上角,电负性小的元素集中在左下角,则电负性:Cl>P>H>Na;
故答案为:Cl>P>H>Na;
(5)氯气与水反应生成盐酸与次氯酸,反应离子方程式为:Cl2+H2O=H++Cl-+HClO,
故答案为:Cl2+H2O=H++Cl-+HClO.
(6)参加反应的P和Cl2的物质的量之比为
:
=0.06:0.13=6:13,n(Cl):n(P)=0.06:(0.13×2)=3:13=1:4.33,则产物有PCl3和PCl5,则其物质的量之比为:
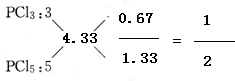
故答案为:PCl3和PCl5;1:2.
(1)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故Na元素的原子半径最大;
最高价含氧酸的酸性越强,中心元素的非金属性越强,高氯酸是最强的含氧酸,故Cl非金属性最强;
故答案为:Na;Cl;
(2)由A和B、D、E所形成的共价型化合物分别为NH3、PH3、HCl,非金属性越强氢化物越稳定,故热稳定性最差的是 PH3,
故答案为:PH3;
(3)甲和乙形成的化合物NH3,价层电子对个数是3+
| 1 |
| 2 |
故答案为:sp3;离子键、共价键;
(4)一般来说,周期表从左到右,元素的电负性逐渐变大;周期表从上到下,元素的电负性逐渐变小.电负性大得元素集中在元素周期表的右上角,电负性小的元素集中在左下角,则电负性:Cl>P>H>Na;
故答案为:Cl>P>H>Na;
(5)氯气与水反应生成盐酸与次氯酸,反应离子方程式为:Cl2+H2O=H++Cl-+HClO,
故答案为:Cl2+H2O=H++Cl-+HClO.
(6)参加反应的P和Cl2的物质的量之比为
| 1.86g |
| 31g/mol |
| 2.912L |
| 22.4L/mol |

故答案为:PCl3和PCl5;1:2.
点评:本题考查位置结构性质关系、元素周期律、化学键等,化学计算,难度中等,推断元素是解题的关键,注意对基础知识的理解掌握.

练习册系列答案
相关题目
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A、常温常压下1mol NO2气体与水反应生成NA个NO3- |
| B、常温下,23gNO2 含有NA个氧原子 |
| C、氯化氢气体的摩尔质量等于NA个氯气分子和NA个氢气分子的质量之和 |
| D、1molFe2+与足量的H2O2溶液反应,转移2NA个电子 |
为提高农作物产量,改善农作物品质,有一种向温室内定期施放CO2的方法是:将工业废稀H2SO4按1:4用水稀释后,盛放在塑料桶内悬挂于1.2米的高处,每天向桶内加入适量的某物质.下列物质中最适宜加入的是( )
| A、CaCO3粉末 |
| B、Na2CO3粉末 |
| C、NH4HCO3 粉末 |
| D、BaCO3粉末 |
下列关于SiO2的说法不正确的是( )
| A、不能与水直接化合生成相应的酸 |
| B、能与强碱溶液反应生成盐和水 |
| C、高纯度的SiO2可以用来制半导体芯片 |
| D、可以被氢氟酸腐蚀 |

