题目内容
7.按下列图示装置,用导线将电极连接起来放置一段时间后,溶液的pH值下降的是( )| A. |  | B. |  | C. |  | D. |  |
分析 用导线将电极连接起来放置一段时间后,形成原电池或电解池,溶液的pH值下降,则氢氧根离子放电,酸性增强,以此来解答.
解答 解:A.该装置是原电池,正极氢离子放电,pH升高,故A错误;
B.该装置是锌的吸氧腐蚀,pH升高,故B错误;
C.该装置是电解池,阳极氯离子放电,阴极是氢离子放电,pH升高,故C错误;
D.该装置是电解池,阳极是氢氧根放电,阴极是铜离子放电,pH降低,故D正确;
故选D.
点评 本题考查原电池和电解池,为高频考点,把握装置的判断、电极反应为解答的关键,侧重分析与应用能力的考查,注意氢氧根离子放电时pH下降,题目难度不大.

练习册系列答案
相关题目
15.用价层电子对互斥理论(VSEPR)预测H2S和NF3的立体结构,两个结论都正确的是( )
| A. | 直线形;三角锥形 | B. | V形;三角锥形 | ||
| C. | 直线形;平面三角形 | D. | V形;平面三角形 |
2.下列元素的原子既可以通过离子键,又可以通过共价键形成二元化合物的是( )
| A. | K | B. | Ca | C. | F | D. | Ne |
12.下列关于元素周期律的叙述中,正确的是( )
| A. | 随着元素原子序数的递增,原子最外层电子总是从1到8重复出现 | |
| B. | 随着元素原子序数的递增,元素最高正价从+1到+7、负价从-7到-1重复出现 | |
| C. | 随着元素原子序数的递增,原子半径从小到大(稀有气体除外)重复出现 | |
| D. | 随着元素原子序数的递增,元素的金属性逐渐减弱,非金属性逐渐增强重复出现 |
19.某研究小组为探究Cu的化学性质及溶液环境对反应的影响,设计并完成了下列实验.
Ⅰ.探究Cu的化学性质
(1)根据化合价分析,在化学反应中铜主要体现出的化学性质是还原性.
(2)写出铜与稀硝酸反应的离子方程式3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O.
(3)向实验①的集气瓶中加水,随着水量的增加,溶液由黄色变为绿色,最后变为蓝色.
【查阅资料】
ⅰ.黄色与蓝色混合呈现绿色.
ⅱ.溶液中存在如下平衡:[Cu(H2O)4]2++4Cl-?[CuCl4]2-+4H2O
利用化学用语和文字解释溶液颜色变化的原因:[CuCl4]2-+4H2O?[Cu(H2O)4]2++4 Cl-,加水过程中,平衡正向移动,随着[Cu(H2O)4]2+的增加,溶液由黄色变为绿色,最后变为蓝色.
(4)反应③中溶液颜色无明显变化,是因为中性环境下反应很难进行.铜表面黑色的物质为CuO,同时有MnO2生成,则中性环境下反应很难进行的原因是:生成的CuO覆盖在铜的表面阻止反应继续.
Ⅱ.探究溶液环境对反应的影响
为进一步研究酸碱性对铜与0.1mol/L KMnO4溶液反应的影响,设计如图实验: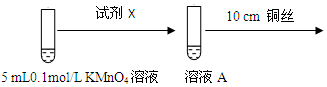
(1)探究酸性条件下反应时,试剂X是.溶液颜色变浅能否说明铜与0.1mol/L KMnO4溶液在酸性条件下发生了反应,理由是如果加入H2SO4溶液的体积是1 mL,对比碱性条件下的实验现象,则能说明发生了反应,如果加入H2SO4溶液的体积是大于1 mL,则有可能是稀释作用导致的溶液颜色变浅.
(2)对于铜与0.1mol/L KMnO4溶液在碱性环境下的反应提出如下假设:
假设Ⅰ:0.1mol/L KMnO4溶液在碱性环境下不能将铜氧化;
假设Ⅱ:0.1mol/L KMnO4溶液在碱性环境下与铜反应较慢.
设计实验验证:
将铜丝紧密缠绕在碳棒上放入碱性的溶液A中,溶液很快由紫红色变为深绿色、.一段时间后,溶液变为浅蓝绿色,试管底部出现棕褐色粉末(MnO2).①反应加快的原因是发生了电化学腐蚀,其正极发生的电极反应式为:MnO4-+e-→MnO42-、MnO42-+2e-+2H2O=MnO2+4OH-.
②通过上述实验得出结论.
Ⅰ.探究Cu的化学性质
| 实验 | 试剂1 | 试剂2 | 操作及现象 |
| ① | 铜丝 | 氯气 | 将加热后的铜丝伸入盛有氯气的集气瓶中,产生棕黄色的烟 |
| ② | 稀硝酸 | 产生无色气体,遇空气变为红棕色 | |
| ③ | 0.1mol/LKMnO4溶液 | 加热后,铜丝表面有黑色物质,溶液颜色无明显变化 |
(2)写出铜与稀硝酸反应的离子方程式3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O.
(3)向实验①的集气瓶中加水,随着水量的增加,溶液由黄色变为绿色,最后变为蓝色.
【查阅资料】
ⅰ.黄色与蓝色混合呈现绿色.
ⅱ.溶液中存在如下平衡:[Cu(H2O)4]2++4Cl-?[CuCl4]2-+4H2O
利用化学用语和文字解释溶液颜色变化的原因:[CuCl4]2-+4H2O?[Cu(H2O)4]2++4 Cl-,加水过程中,平衡正向移动,随着[Cu(H2O)4]2+的增加,溶液由黄色变为绿色,最后变为蓝色.
(4)反应③中溶液颜色无明显变化,是因为中性环境下反应很难进行.铜表面黑色的物质为CuO,同时有MnO2生成,则中性环境下反应很难进行的原因是:生成的CuO覆盖在铜的表面阻止反应继续.
Ⅱ.探究溶液环境对反应的影响
为进一步研究酸碱性对铜与0.1mol/L KMnO4溶液反应的影响,设计如图实验:

| 环境 | 反应现象 |
| 酸性 | 溶液紫红色变浅 |
| 碱性(1mL 1mol/L NaOH溶液) | 无明显现象 |
(2)对于铜与0.1mol/L KMnO4溶液在碱性环境下的反应提出如下假设:
假设Ⅰ:0.1mol/L KMnO4溶液在碱性环境下不能将铜氧化;
假设Ⅱ:0.1mol/L KMnO4溶液在碱性环境下与铜反应较慢.
设计实验验证:
将铜丝紧密缠绕在碳棒上放入碱性的溶液A中,溶液很快由紫红色变为深绿色、.一段时间后,溶液变为浅蓝绿色,试管底部出现棕褐色粉末(MnO2).①反应加快的原因是发生了电化学腐蚀,其正极发生的电极反应式为:MnO4-+e-→MnO42-、MnO42-+2e-+2H2O=MnO2+4OH-.
②通过上述实验得出结论.
16.下列实验原理或操作正确的是( )
| A. | 浓硝酸光照逐渐变黄,说明光照分解生成的有色产物能溶于其中 | |
| B. | 中和滴定时,眼睛应注视滴定管中的液面下降 | |
| C. | 向饱和FeCl3溶液中滴加过量氨水,可制得Fe(OH)3胶体 | |
| D. | 配制一定物质的量浓度的溶液时,应将刚溶解后的溶液立即转移到容量瓶中 |
20.下列化学方程式中,书写正确的是( )
| A. | Al+O2$\frac{\underline{\;点燃\;}}{\;}$AlO2 | B. | C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2 | ||
| C. | 2H2O═2H2+O2 | D. | Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2↑ |