题目内容
如图是一个化学过程的示意图.

已知甲池的总反应式为:2CH3OH+3O2+4KOH
2K2CO3+6H2O
(1)请回答图中:甲池是 装置.乙池中A极的名称为 .
(2)写出通入CH3OH的电极的电极反应式是 .
(3)已知粗铜含铁、锌、银、金等杂质,乙池中Cu2+的浓度将 (填“增大”“减小”或“不变”).
(4)当乙池中B极的质量变化6.40g时,理论上C极上质量 (填“增大”、“减小”或“不变”) g(精确到0.01g);D极上电极反应式: .

已知甲池的总反应式为:2CH3OH+3O2+4KOH
| 充电 |
| 放电 |
(1)请回答图中:甲池是
(2)写出通入CH3OH的电极的电极反应式是
(3)已知粗铜含铁、锌、银、金等杂质,乙池中Cu2+的浓度将
(4)当乙池中B极的质量变化6.40g时,理论上C极上质量
考点:原电池和电解池的工作原理
专题:电化学专题
分析:甲池能自发的进行氧化还原反应,属于原电池,通入甲醇的电极为负极、通入氧气的电极为正极,则乙池、丙池是电解池,A、C属于阳极,B、D属于阴极,A电极反应式为Cu-2e-=Cu2+、B极反应式为Cu2++2e-=Cu、C极反应式为Pb-2e-=Pb2+、D极反应式为PbSO4+2e-=Pb+SO42-,据此分析解答.
解答:
解:(1)甲池能自发的进行氧化还原反应,属于燃料电池,为原电池,通入甲醇的电极为负极、通入氧气的电极为正极,乙为电解池,A连接原电池正极,则为阳极,
故答案为:原电池;阳极;
(2)碱性条件下,甲醇失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为CH3OH+8OH--6e-=CO32-+6H2O,故答案为:CH3OH+8OH--6e-=CO32-+6H2O;
(3)乙池属于电解精炼粗铜电解池,A电极上Cu、Fe、Zn、Ag都失电子发生氧化反应,B电极上只有铜离子放电生成Cu,所以电解质溶液中铜离子浓度减小,故答案为:减小;
(4)C极反应式为Pb-2e-=Pb2+,根据转移电子相等知,n(Cu)=n(Pb)=
=0.1mol,则减少质量=0.1mol×207g/mol=20.70g,D电极上电极反应式为PbSO4+2e-=Pb+SO42-,
故答案为:减小;20.70;PbSO4+2e-=Pb+SO42-.
故答案为:原电池;阳极;
(2)碱性条件下,甲醇失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为CH3OH+8OH--6e-=CO32-+6H2O,故答案为:CH3OH+8OH--6e-=CO32-+6H2O;
(3)乙池属于电解精炼粗铜电解池,A电极上Cu、Fe、Zn、Ag都失电子发生氧化反应,B电极上只有铜离子放电生成Cu,所以电解质溶液中铜离子浓度减小,故答案为:减小;
(4)C极反应式为Pb-2e-=Pb2+,根据转移电子相等知,n(Cu)=n(Pb)=
| 6.40g |
| 64g/mol |
故答案为:减小;20.70;PbSO4+2e-=Pb+SO42-.
点评:本题考查了电解池和原电池原理,明确各个电极上发生的反应即可解答,会正确书写电极反应式,难点是燃料电池负极反应式,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
化学与生产、生活、社会密切相关.下列说法中不正确的是( )
| A、不需要通过化学反应就能从海水中获得食盐和淡水 |
| B、铁在潮湿的空气中放置,易发生化学腐蚀而生锈 |
| C、高空臭氧层吸收太阳紫外线,保护地球生物;低空过量臭氧是污染气体,对人体有害 |
| D、氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂 |
设NA代表阿伏伽德罗常数,下列说法正确的是( )
| A、1molNa2O2中含4NA个离子 |
| B、常温常压下,46gNO2和N2O4混合物含有原子数为3NA |
| C、标准状况下,22.4LCHCl3中含有的氯原子数为3NA |
| D、18gD2O中含有的质子数为10NA |
 科学研究表明,月球上可能存在少量水:月岩中含有钛铁矿,其主要成分的晶胞如图所示.
科学研究表明,月球上可能存在少量水:月岩中含有钛铁矿,其主要成分的晶胞如图所示. 铈、铬、钴、镍虽不是中学阶段常见的金属元素,但在工业生产中有着重要作用.
铈、铬、钴、镍虽不是中学阶段常见的金属元素,但在工业生产中有着重要作用.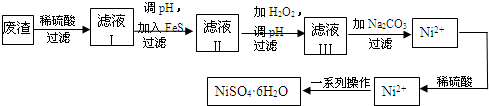
 有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示.电池正极的电极反应式是
有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示.电池正极的电极反应式是