题目内容
已知将浓盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去.现有一个氧化还原反应的体系中共有KCl.Cl2.H2SO4.H2O.KMnO4.MnSO4.K2SO4七种物质:
(1)该反应中,化合价升高的反应物是 .
(2)写出一个包含上述七种物质的氧化还原反应方程式:
(3)上述反应中,氧化剂是 ,1mol氧化剂在反应中得到 mol电子.
(1)该反应中,化合价升高的反应物是
(2)写出一个包含上述七种物质的氧化还原反应方程式:
(3)上述反应中,氧化剂是
考点:氧化还原反应
专题:氧化还原反应专题
分析:(1)由题意可知,高锰酸钾具有氧化性,则还原反应为KMnO4→MnSO4,则在给出的物质中由Cl元素的化合价变化,则氧化反应为KCl→Cl2;
(2)由浓盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去,则高锰酸钾具有氧化性,则还原反应为KMnO4→MnSO4,则在给出的物质中由Cl元素的化合价变化,则氧化反应为KCl→Cl2,然后来书写氧化还原反应;
(3)得电子化合价降低的反应物是氧化剂,根据氧化剂和转移电子之间的关系式计算.
(2)由浓盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去,则高锰酸钾具有氧化性,则还原反应为KMnO4→MnSO4,则在给出的物质中由Cl元素的化合价变化,则氧化反应为KCl→Cl2,然后来书写氧化还原反应;
(3)得电子化合价降低的反应物是氧化剂,根据氧化剂和转移电子之间的关系式计算.
解答:
解:(1)由题意可知,高锰酸钾具有氧化性,则还原反应为KMnO4→MnSO4,则在给出的物质中由Cl元素的化合价变化,则氧化反应为KCl→Cl2,Cl元素化合价由-1价变为0价,所以化合价升高的反应物是KCl,
故答案为:KCl;
(2)由题意可知,高锰酸钾具有氧化性,则还原反应为KMnO4→MnSO4,则在给出的物质中由Cl元素的化合价变化,则氧化反应为KCl→Cl2,则反应为KMnO4+KCl+H2SO4→MnSO4+K2SO4+Cl2↑+H2O,由电子守恒及原子守恒可得配平后的化学反应为2KMnO4+10KCl+8H2SO4(浓)═2MnSO4+6K2SO4+5Cl2↑+8H2O,
故答案为:2KMnO4+10KCl+8H2SO4(浓)═2MnSO4+6K2SO4+5Cl2↑+8H2O;
(3)该反应2KMnO4+10KCl+8H2SO4(浓)═2MnSO4+6K2SO4+5Cl2↑+8H2O中,Mn元素化合价由+7价变为+2价、Cl元素化合价由-1价变为0价,所以氧化剂是KMnO4,1mol氧化剂在反应中得到电子的物质的量=1mol×(7-2)=5mol,故答案为:KMnO4;5.
故答案为:KCl;
(2)由题意可知,高锰酸钾具有氧化性,则还原反应为KMnO4→MnSO4,则在给出的物质中由Cl元素的化合价变化,则氧化反应为KCl→Cl2,则反应为KMnO4+KCl+H2SO4→MnSO4+K2SO4+Cl2↑+H2O,由电子守恒及原子守恒可得配平后的化学反应为2KMnO4+10KCl+8H2SO4(浓)═2MnSO4+6K2SO4+5Cl2↑+8H2O,
故答案为:2KMnO4+10KCl+8H2SO4(浓)═2MnSO4+6K2SO4+5Cl2↑+8H2O;
(3)该反应2KMnO4+10KCl+8H2SO4(浓)═2MnSO4+6K2SO4+5Cl2↑+8H2O中,Mn元素化合价由+7价变为+2价、Cl元素化合价由-1价变为0价,所以氧化剂是KMnO4,1mol氧化剂在反应中得到电子的物质的量=1mol×(7-2)=5mol,故答案为:KMnO4;5.
点评:本题考查了氧化还原反应,明确元素化合价变化是解本题关键,再结合转移电子守恒、物质之间的关系解答,题目难度不大.

练习册系列答案
相关题目
 X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是次外层电子数的3倍,下列说法正确的是( )
X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是次外层电子数的3倍,下列说法正确的是( )| A、原子半径:X<Z<W |
| B、非金属性:Y>Z |
| C、最高化合价:X<Y |
| D、最高价氧化物对应水化物的酸性:W>Z |
在pH=1的溶液中,可以大量共存的离子组是( )
| A、Na+、K+、S2-、Cl- |
| B、Al3+、HCO3-、SO42-、Cl- |
| C、K+、Na+、SiO32-、NO3- |
| D、K+、Cl-、SO42-、NO3- |
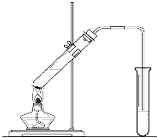 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
 黑火药爆炸时发生多种化学反应,其中主要化学反应方程式为:
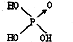
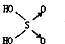
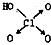
黑火药爆炸时发生多种化学反应,其中主要化学反应方程式为: (1)判断含氧酸酸性强弱的一条经验规律是:含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性就越强.含氧酸酸性强弱与非羟基氧原子数的关系如下表所示:
(1)判断含氧酸酸性强弱的一条经验规律是:含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性就越强.含氧酸酸性强弱与非羟基氧原子数的关系如下表所示: