题目内容
 铈、铬、钴、镍虽不是中学阶段常见的金属元素,但在工业生产中有着重要作用.
铈、铬、钴、镍虽不是中学阶段常见的金属元素,但在工业生产中有着重要作用.(1)二氧化铈 (CeO2)在平板电视显示屏中有着重要应用.CeO2在稀硫酸和H2O2的作用下可生成Ce3+,CeO2在该反应中作
(2)自然界Cr主要以+3价和+6价存在.+6价的Cr能引起细胞的突变,可以用亚硫酸钠将其还原为+3价的铬.完成并配平下列离子方程式:
(3)某锂离子电池用含有Li+的导电固体作为电解质.充电时,Li+还原为Li,并以原子形式嵌入电极材料C6中,以LiC6表示,电池反应为CoO2+LiC6
| 放电 |
| 充电 |
(4)脱硝.利用甲烷催化还原NOx:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ?mol-1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ?mol-1
甲烷直接将NO2还原为N2的热化学方程式为
(5)NiSO4?6H2O是一种绿色易溶于水的晶体,广泛用于镀镍、电池等,可由电镀废渣(除镍外,还含有铜、锌、铁等元素)为原料获得.操作步骤如下:
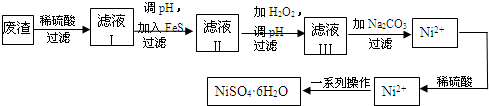
废渣稀硫酸过滤滤液Ⅰ调pH,加入FeS过滤加H2O2,调pH过滤加Na2CO3过滤Ni2+CO3滤液Ⅱ滤液Ⅲ稀硫酸Ni2+HSO4一系列操作NiSO4?6H2O
①向滤液Ⅰ中加入FeS是为了除去Cu2+、Zn2+等杂质,除去Cu2+的离子方程式为
②对滤液Ⅱ调pH的目的是除去Fe3+,其原理是Fe3++3H2O?Fe(OH)3+3H+,已知25℃时Ksp[Fe(OH)3]=2.8×10-39,则该温度下上述反应的平衡常数K=
③滤液Ⅲ溶质的主要成分是NiSO4,加Na2CO3过滤后,再加适量稀硫酸溶解又生成NiSO4,这两步操作的目的是
考点:物质分离和提纯的方法和基本操作综合应用,氧化还原反应,氧化还原反应方程式的配平,热化学方程式,物质的分离、提纯的基本方法选择与应用
专题:实验设计题,氧化还原反应专题
分析:(1)CeO2在稀硫酸和H2O2的作用下可生成Ce3+,Ce元素的化合价由+4价降低为+3价;
(2)从质量守恒、电荷守恒和电子守恒的角度配平方程式;
(3)放电时,电池的正极发生还原反应,被CoO2还原生成LiCoO2;根据电子和离子的定向移动方向判断电极;
(4)①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ?mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ?mol-1,
由盖斯定律可知(①+②)÷2可知甲烷直接将NO2还原为N2的热化学方程式;
(5)①加入FeS,可转化为溶解度更小的难溶电解质;
②Fe3++3H2O?Fe(OH)3+3H+,K=
,25℃时Ksp[Fe(OH)3]=2.8×10-39,Ksp=c(Fe3+)×c3(OH-),Ka=c(H+)×c(OH-),则K=
;
③滤液Ⅱ中含有Fe2+,可与过氧化氢发生氧化还原反应生成Fe3+,调节pH,可有利于Fe3+的水解.
(2)从质量守恒、电荷守恒和电子守恒的角度配平方程式;
(3)放电时,电池的正极发生还原反应,被CoO2还原生成LiCoO2;根据电子和离子的定向移动方向判断电极;
(4)①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ?mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ?mol-1,
由盖斯定律可知(①+②)÷2可知甲烷直接将NO2还原为N2的热化学方程式;
(5)①加入FeS,可转化为溶解度更小的难溶电解质;
②Fe3++3H2O?Fe(OH)3+3H+,K=
| c3(H+) |
| c(Fe3+) |
| (Ka)3 |
| Ksp |
③滤液Ⅱ中含有Fe2+,可与过氧化氢发生氧化还原反应生成Fe3+,调节pH,可有利于Fe3+的水解.
解答:
解:(1)CeO2在稀硫酸和H2O2的作用下可生成Ce3+,Ce元素的化合价由+4价降低为+3价,则CeO2在反应中作氧化剂,故答案为:氧化;
(2)反应中Cr元素化合价由+6价降低到+3价,S元素化合价由+4价升高到+6价,则最小公倍数为12,由电子守恒和原子守恒、电荷守恒可知配平后的离子方程式为Cr2O72-+3SO32-+8H+═2Cr3++3SO42-+4H20,故答案为:1;3;8H+;2;3;4;
(3)放电时,电池的正极发生还原反应,被CoO2还原生成LiCoO2,电极方程式为CoO2+Li++e-=LiCoO2,图1中电子向C6极移动,如C6为负极,则移向C6的离子应为阴离子,而移向C6的为阳离子,则C6应为阴极,此时该电池处于充电状态,
故答案为:CoO2+Li++e-=LiCoO2;充电;
(4)①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ?mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ?mol-1,
由盖斯定律可知(①+②)÷2可知甲烷直接将NO2还原为N2的热化学方程式为CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867kJ/mol,
故答案为:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867kJ/mol;
(5)①向滤液Ⅰ中加入FeS主要目的是除去Cu、Zn等杂质,说明CuS的溶解度更小,反应的离子方程式为FeS(aq)+Cu2+(aq)=Fe2+(aq)+CuS(aq),
故答案为:FeS(aq)+Cu2+(aq)=Fe2+(aq)+CuS(aq);
②Fe3++3H2O?Fe(OH)3+3H+,K=
,25℃时Ksp[Fe(OH)3]=2.8×10-39,Ksp=c(Fe3+)×c3(OH-),Ka=c(H+)×c(OH-),则K=
=
=3.6×10-4,故答案为:3.6×10-4;
③滤液Ⅲ溶质的主要成分是NiSO4,再加入碳酸钠过滤后,加稀硫酸溶解又生成NiSO4,可增大成NiSO4浓度,有利于蒸发结晶,
故答案为:增大NiSO4浓度,有利于蒸发结晶.
(2)反应中Cr元素化合价由+6价降低到+3价,S元素化合价由+4价升高到+6价,则最小公倍数为12,由电子守恒和原子守恒、电荷守恒可知配平后的离子方程式为Cr2O72-+3SO32-+8H+═2Cr3++3SO42-+4H20,故答案为:1;3;8H+;2;3;4;
(3)放电时,电池的正极发生还原反应,被CoO2还原生成LiCoO2,电极方程式为CoO2+Li++e-=LiCoO2,图1中电子向C6极移动,如C6为负极,则移向C6的离子应为阴离子,而移向C6的为阳离子,则C6应为阴极,此时该电池处于充电状态,
故答案为:CoO2+Li++e-=LiCoO2;充电;
(4)①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ?mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ?mol-1,
由盖斯定律可知(①+②)÷2可知甲烷直接将NO2还原为N2的热化学方程式为CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867kJ/mol,
故答案为:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867kJ/mol;
(5)①向滤液Ⅰ中加入FeS主要目的是除去Cu、Zn等杂质,说明CuS的溶解度更小,反应的离子方程式为FeS(aq)+Cu2+(aq)=Fe2+(aq)+CuS(aq),
故答案为:FeS(aq)+Cu2+(aq)=Fe2+(aq)+CuS(aq);
②Fe3++3H2O?Fe(OH)3+3H+,K=
| c3(H+) |
| c(Fe3+) |
| (Ka)3 |
| Ksp |
| (1×10-14)3 |
| 2.8×10-39 |
③滤液Ⅲ溶质的主要成分是NiSO4,再加入碳酸钠过滤后,加稀硫酸溶解又生成NiSO4,可增大成NiSO4浓度,有利于蒸发结晶,
故答案为:增大NiSO4浓度,有利于蒸发结晶.
点评:本题考查较为综合,涉及氧化还原反应、盐类的水解、物质的分离提纯以及原电池知识,侧重于学生的分析能力和实验能力、计算能力的考查,为高频考点和常见题型,题目难度中等,注意把握基础知识的积累.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
在100℃时,将N2O4、NO2分别充入两个各为1L的密闭容器中.发生反应;2NO2(g)?N2O4(g)△H<0.反应过程中浓度变化如下:下列说法正确的是( )
| 容器 | 物质 | 起始浓度/(mol?L-1 | 平衡浓度/(mol?L-1 |
| Ⅰ | N2O4 | 0.100 | 0.040 |
| NO2 | 0 | 0.120 | |
| Ⅱ | N2O4 | 0 | 0.014 |
| NO2 | 0.100 | 0.072 |
| A、平衡后,分别压缩容器Ⅰ、Ⅱ,则Ⅰ、Ⅱ中气体颜色都将变深 |
| B、平衡时,Ⅰ、Ⅱ中反应物的转化率a(N2O4)<a(NO2) |
| C、平衡时,Ⅰ、Ⅱ中反应的平衡常数K(Ⅰ)═2K(Ⅱ) |
| D、平衡后,升高相同温度,以N2O4表示的反应速率v(Ⅰ)<v(Ⅱ) |
 短周期金属元素甲~戊在元素周期表中的相对位置如图所示.下列判断正确的是( )
短周期金属元素甲~戊在元素周期表中的相对位置如图所示.下列判断正确的是( )| A、原子半径:丙<丁<戊 |
| B、金属性:甲>丙 |
| C、氢氧化物碱性:丙>丁>戊 |
| D、最外层电子数:甲>乙 |
 黑火药爆炸时发生多种化学反应,其中主要化学反应方程式为:
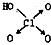
黑火药爆炸时发生多种化学反应,其中主要化学反应方程式为: (1)判断含氧酸酸性强弱的一条经验规律是:含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性就越强.含氧酸酸性强弱与非羟基氧原子数的关系如下表所示:
(1)判断含氧酸酸性强弱的一条经验规律是:含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性就越强.含氧酸酸性强弱与非羟基氧原子数的关系如下表所示: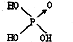

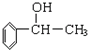 (1)苏合香醇可以用作食用香精,其结构简式如图所示.
(1)苏合香醇可以用作食用香精,其结构简式如图所示.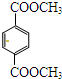 的同分异构体有多种,满足下列条件的共有
的同分异构体有多种,满足下列条件的共有