题目内容
8. 研究硫酸工业原理及含硫化合物的性质具有重要意义.
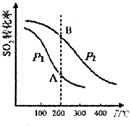
研究硫酸工业原理及含硫化合物的性质具有重要意义.(1)硫酸工业生产中涉及反应:2SO2(g)+O2(g)?2SO3(g)△H<0,SO2的平衡转化率与温度、压强的关系如右图所示,则:
①压强:P1<P2(填“>”、“=”或“<”).
②A、B两点的平衡常数:K(A)=K(B)(填“>”、“=”或“<”).
③200℃时,将一定量的SO2和O2充入容积不变的密闭容器中,经10min后测得容器中各物质的物质的量浓度如下表所示:
| 气体 | SO2 | O2 | SO3 |
| 浓度(mol•L-1) | 0.4 | 1.2 | 1.6 |
a.v正(O2)=v逆(SO3) b.SO2和SO3物质的量之和保持不变
c.混合气体的密度保持不变 d.体系的压强保持不变
(2)Cu2S在高温条件下发生如下反应:2Cu2S(s)+3O2(g)═2Cu2O(s)+2SO2(g)△H=-773kJ•mol-1
当该反应有1.2mol电子转移时,反应释放出的热量为77.3kJ.
(3)某研究小组把钢铁中的硫转化为H2SO3溶液,然后用标准浓度的I2溶液进行滴定,滴定中使用的指示剂为淀粉试液(写名称),滴定过程中c(SO32-)减小(填“增大”、“减小”或“不变”).
(4)利用反应2SO2+O2+2H2O═2H2SO4可以处理SO2尾气,若将该反应设计为原电池,用稀硫酸作电解质溶液,其正极电极反应式为4H++O2+4e-═2H2O.
分析 (1)①根据图知,相同温度下,增大压强,平衡正向移动,则二氧化硫转化率增大;
②化学平衡常数只与温度有关;
③在0~10min内,v(SO3)=$\frac{1.6mol/L}{10min}$=0.16mol/(L•min),同一可逆反应中同一时间段内各物质的反应速率之比等于其计量数之比,据此计算氧气反应速率;可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量不变、物质的量浓度不变、质量分数不变以及由此引起的一系列物理量不变;
(2)根据反应热和转移电子之间的关系式计算;
(3)I2溶液滴定管为酸式滴定管,因为I2遇到淀粉会变蓝色,所以可以用淀粉溶液作指示剂;根据反应H2SO3+I2+H2O=4H++SO42-+2I-来解答;
(4)根据原电池原理,正极发生的是化合价降低得电子的还原反应;
解答 解:(1)①根据图知,相同温度下,增大压强,平衡正向移动,则二氧化硫转化率增大,相同温度下,P1 时二氧化硫转化率小于P2时二氧化硫转化率,则P1<P2,故答案为:<;
②化学平衡常数只与温度有关,相同温度下,所以A、B点的化学平衡常数相等,故答案为:=;
③在0~10min内,v(SO3)=$\frac{1.6mol/L}{10min}$=0.16mol/(L•min),同一可逆反应中同一时间段内各物质的反应速率之比等于其计量数之比,所以v(O2)=$\frac{1}{2}$v(SO3)=$\frac{1}{2}$×0.16mol/(L•min)=0.08mol•L-1•min-1,
a.2v正(O2)=v逆(SO3),正逆反应速率相等,反应达到平衡状态,故a错误;
b.无论反应是否达到平衡状态,SO2和SO3物质的量之和始终保持不变,所以不能据此判断平衡状态,故b错误;
c.反应前后气体质量不变、容器体积不变,所以混合气体的密度始终保持不变,则不能根据密度判断平衡状态,故c错误;
d.该反应是一个反应前后气体体积改变的可逆反应,当体系的压强保持不变,正逆反应速率相等,反应达到平衡状态,故d正确;
故答案为:0.08mol•L-1•min-1;d;
(2)该反应2Cu2S(s)+3O2(g)═2Cu2O(s)+2SO2(g)中,当转移12mol电子时放出773kJ热量,当转移1.2mol电子时放出热量77.3kJ热量;
故答案为:77.3;
(3)I2溶液滴定管为酸式滴定管,因为I2遇到淀粉会变蓝色,所以可以用淀粉溶液作指示剂,滴定终点时溶液的颜色变化为无色变为蓝色;
由反应的离子方程式H2SO3+I2+H2O=4H++SO42-+2I-可知c(SO32-)减小;
故答案为:淀粉试液;减小;
(4)原电池正极发生的是化合价降低得电子的反应,根据方程式可知是O2得电子,另外,由于H2SO4存在,所以发生的O2酸性条件下的电极反应:4H++O2+4e-═2H2O;
故答案为:4H++O2+4e-═2H2O.
点评 本题考查化学平衡状态判断、氧化还原反应、图象分析等知识点等,清楚发生的电极反应是解题的关键,是对学生综合能力的考查,难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 相同的元素可以组成不同的化合物 | B. | 物质均由元素组成 | ||
| C. | 只含一种元素的物质是单质 | D. | 混合物中一定有很多种元素 |
| A. | 在500℃、20 MPa条件下,在5 L密闭容器中进行合成氨的反应,使用催化剂后K增大 | |
| B. | 相同温度下的酸、碱、盐的稀溶液中水的离子积常数KW不同 | |
| C. | Ksp不仅与难溶电解质的性质和温度有关,还与溶液中相关离子的浓度有关 | |
| D. | 室温下K(HCN)<K(CH3COOH),等浓度的HCN和CH3COOH溶液pH较小的为CH3COOH |
 最多有几个原子在同一平面上( )
最多有几个原子在同一平面上( )| A. | 12 | B. | 20 | C. | 22 | D. | 24 |
| A. | 该溶液中氢离子的浓度:c(H+)=1×10-11 mol/L | |
| B. | 0.1 mol/L氨水溶液与0.1 mol/L HCl溶液等体积混合后所得溶液中:c(NH4+)+c(H+)=c(Cl-)+c(OH-) | |
| C. | 0.1 mol/L的氨水溶液与0.05 mol/L H2SO4溶液等体积混合后所得溶液中:c(NH4+)+c(NH3•H2O)=2c(SO42-) | |
| D. | 浓度均为0.1 mol/L的NH3•H2O和NH4Cl溶液等体积混合后,若溶液呈碱性,则c(NH4+)>c(NH3•H2O)>c(Cl-)>c(OH-)>c(H+) |
| A. | 大力开发可再生资源,可推广以乙醇汽油代替传统燃油技术 | |
| B. | 某些不合格建筑装饰材料,会缓慢释放甲醛、甲苯等有机物蒸气 | |
| C. | 食品加工消毒防腐常使用福尔马林 | |
| D. | 松花江水域的苯、硝基苯污染物可用活性炭吸附处理 |
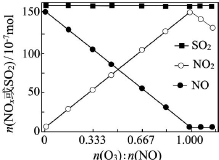 烟气(主要污染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量.O3氧化烟气中SO2、NOx的主要反应的热化学方程式为:
烟气(主要污染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量.O3氧化烟气中SO2、NOx的主要反应的热化学方程式为:
 向100mL 3mol/L的NaOH溶液中缓慢通入一定量的CO2,充分反应,测得最后溶液的PH>7.
向100mL 3mol/L的NaOH溶液中缓慢通入一定量的CO2,充分反应,测得最后溶液的PH>7.