题目内容
1.燃煤和汽车产生的氮氧化物、碳氧化物是造成空气污染的重要原因.依据信息回答下列问题.I.用CH4催化还原氮氧化物可以消除氮氧化物的污染.己知:
①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ•mol-1
③CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H3
(1)△H3=CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867kJ•mol-1.
Ⅱ.汽车尾气净化的主要原理为:2NO(g)+2CO(g)$\stackrel{催化剂}{?}$2CO2(g)+N2(g)△H<0
(2)若该反应在恒温、恒压的密闭体系中进行,下列叙述能说明反应达到平衡状态的是ac.
a.容器总体积不再改变 b.n(NO)=n(CO2) c.v正(CO)=v逆(CO2)
(3)在一定温度下,向2L的恒容密闭容器中充入O.lmol NO和0.3molCO,如图1为容器内的压强(P)与起始压强(P${\;}_{{\;}_{0}}$)的比值($\frac{P}{{P}_{0}}$)随时间的变化曲线.
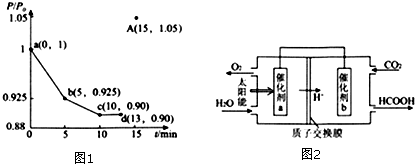
①该反应的化学平衡常数K表达式为$\frac{{C}^{2}(C{O}_{2})•C({N}_{2})}{{C}^{2}(NO)•{C}^{2}(CO)}$;
②0~5min内,该反应的平均反应速率v(N2)=0.003mol/(L•min);
③若13min时,向该容器中再充入0.06molCO,15min时再次达到平衡,此时容器内$\frac{P}{{P}_{0}}$的比值应在图1中A点的下方 (填“上方”、“重合”或“下方”)
Ⅲ.将燃煤产生的CO2回收利用.也可达到低碳排放的目的.
(4)如图2是通过人工光合作用,以CO2和H2O为原料制备HCOOH和O2的原理示意图.催化剂b表面发生的电极反应式为CO2+2H++2e-=HCOOH.常温下.0.1mol/L 的HCOONa 溶液pH为9,则HCOOH的电离常数Ka=10-7.
分析 (1)已知①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1,
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1 160kJ•mol-1,
利用盖斯定律③=$\frac{①+②}{2}$,
可得CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g),△H=-$\frac{574+1160}{2}$kJ•mol-1=867kJ•mol-1,以此解答该题;
(2)当化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再发生变化,进行分析解答该题;
(3)①根据反应方程式可以写出平衡常数表达式;②根据反应前后压强的变化可以求算出N2物质的量的变化,运用化学反应速率求算公式据算出结果;③根据13min钟时压强为起始时的0.9可以推算此时容器内的气体总的物质的量,再通入0.06molCO可推出压强为起始时的1.05倍,根据平衡移动原理可以得出结论;
(4)由图可知,左室投入水,生成氧气与氢离子,催化剂a表面发生氧化反应,为负极,右室通入二氧化碳,酸性条件下生成HCOOH;计算水解平衡常数Kh,再根据Ka=$\frac{{K}_{W}}{{K}_{h}}$计算.
解答 解:(1)已知①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1,
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1 160kJ•mol-1,
利用盖斯定律将得③=$\frac{①+②}{2}$,
可得CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g),△H=-$\frac{574+1160}{2}$kJ•mol-1=-867kJ•mol-1
故答案为:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867kJ•mol-1;
(2)已知反应为2NO(g)+2CO(g)$\stackrel{催化剂}{?}$2CO2(g)+N2(g)△H<0,恒压条件下反应正向、逆向体积都发生变化,如果体积不变说明反应达到平衡状态,故a正确;达到平衡时各组分的物质的量不变,故答案b错误;根据平衡时正逆反应速率相等可以推断c正确,
故答案为ac;
(3)①根据反应方程式2NO(g)+2CO(g)$\stackrel{催化剂}{?}$2CO2(g)+N2可以写出平衡常数为$\frac{{{C}^{2}}_{(C{O}_{2)}}•C({N}_{2})}{{C}^{2}(NO)•{C}^{2}(CO)}$,故答案为$\frac{{C}^{2}(C{O}_{2})•C({N}_{2})}{{C}^{2}(NO)•{C}^{2}(CO)}$;
②2NO+2CO?2CO2 +N2
起始:0.1 0.3
△:x x x 0.5x
平衡:0.1-x 0.3-x x 0.5x
$\frac{P}{{P}_{0}}$=$\frac{0.1-x+0.3-x+x+0.5x}{0.1+0.3}$=0.925,x=0.06mol,${V}_{({N}_{2})}$=$\frac{△C({N}_{2})}{△t}$=$\frac{\frac{0.06mol}{2L}}{5min}$=0.003mol/(L•min);
③2 NO(g)+2CO(g)?2CO2(g)+N2(g)
起始:0.1 0.3
△:a a a 0.5a
平衡:0.1-a 0.3-a a 0.5a
$\frac{0.1-a+0.3-a+a+0.5a}{0.1+0.3}$=0.9 a=0.08mol 此时容器内气体总物质的量为0.36mol,再加入0.06mol,气体总物质的量0.42,此时压强为起始压强的$\frac{0.42}{0.4}$=1.05,依据平衡移动原理可知加入CO平衡向正向移动,气体体积减小,压强减小,所以压强与起始压强的比值<1.05,
故答案为:下方;
(4)由图可知,左室投入水,生成氧气与氢离子,催化剂a表面发生氧化反应,为负极,右室通入二氧化碳,酸性条件下生成HCOOH,电极反应式为CO2+2H++2e-=HCOOH,
故答案为:CO2+2H++2e-=HCOOH;
常温下,0.1mol/L的HCOONa溶液pH为10,溶液中存在HCOO-水解HCOO-+H2O?HCOOH+OH-,故Kh=$\frac{{C}_{(OH-)•}{C}_{(HCOOH)}}{{C}_{(HCOO-)}}$=$\frac{10-4×10-4}{0.1-10-4}$=10-7,则HCOOH的电离常数Ka=$\frac{{C}_{(H+)}•C(HCOO-)}{C(HCOOH)}$=$\frac{KW}{Kh}$=$\frac{1{0}^{-14}}{{10}^{-7}}$=10-7,
故答案为:10-7.
点评 本题考查化学平衡图象、化学反应速率、影响化学平衡的因素、热化学方程式书写、原电池、电离平衡常数与水解平衡常数等,题目综合性较大,难度中等,是对知识的综合利用、注意基础知识的理解掌握.

| A. | 铝 | B. | 钛 | C. | 镁 | D. | 铁 |
 最多有几个原子在同一平面上( )
最多有几个原子在同一平面上( )| A. | 12 | B. | 20 | C. | 22 | D. | 24 |
| A. | 海水中含有钾元素,只需经过物理变化就可以得到钾单质 | |
| B. | 海水蒸发制海盐的过程中只发生了化学变化 | |
| C. | 从海水中可以得到NaCl,电解NaCl可以制备Na | |
| D. | 利用潮汐发电是将化学能转化为电能 |