题目内容
氯气是一种重要的化工原料,自来水消毒、农药的生产、药物的合成等都需要用到氯气.
Ⅰ.工业上通常采用电解法制氯气:观察如图,回答:
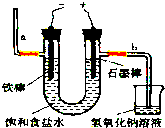
(1)若饱和食盐水中含有酚酞,通电后 (填a或b)侧先变红.
(2)电解反应的化学方程式为 .
(3)生产的氯气常用于制备漂白粉,请写出漂白粉长期露置在空气中失效,且属于氧化还原反应的一条化学方程式 .
Ⅱ.如图所示为常见气体的制备、除杂、性质验证和尾气处理等实验的仪器装置(加热设备及部分夹持固定装置已略去).请根据要求完成下列各题.
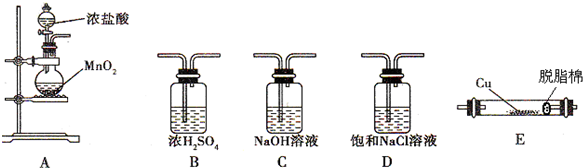
(1)若实验室制取纯净、干燥的Cl2,并进行检验其和铜的反应.所选装置的顺序依次为(从左向
右) ;
(2)写出A中反应的化学方程式并用双线桥法表示反应中电子转移的方向和数目 ;若在标准状态下收集到2.24L氯气,则被氧化的HCl的物质的量是 mol.
(3)E管中现象 .脱脂棉的作用是 .
Ⅰ.工业上通常采用电解法制氯气:观察如图,回答:

(1)若饱和食盐水中含有酚酞,通电后
(2)电解反应的化学方程式为
(3)生产的氯气常用于制备漂白粉,请写出漂白粉长期露置在空气中失效,且属于氧化还原反应的一条化学方程式
Ⅱ.如图所示为常见气体的制备、除杂、性质验证和尾气处理等实验的仪器装置(加热设备及部分夹持固定装置已略去).请根据要求完成下列各题.

(1)若实验室制取纯净、干燥的Cl2,并进行检验其和铜的反应.所选装置的顺序依次为(从左向
右)
(2)写出A中反应的化学方程式并用双线桥法表示反应中电子转移的方向和数目
(3)E管中现象
考点:氯气的实验室制法,电解原理
专题:
分析:Ⅰ(1)电解饱和食盐水可以得到氢氧化钠、氯气和氢气;
(2)电解饱和食盐水生成氢氧化钠、氢气和氯气;
(3)次氯酸不稳定,能发生氧化还原反应;
Ⅱ(1)按照发生装置,除杂、干燥装置,检验性质,尾气吸收装置的顺序组装;
(2)A中为浓盐酸和二氧化锰的反应;
(3)先产生氯气,让氯气排净装置中的空气,然后开始氯气和铜的反应.
(2)电解饱和食盐水生成氢氧化钠、氢气和氯气;
(3)次氯酸不稳定,能发生氧化还原反应;
Ⅱ(1)按照发生装置,除杂、干燥装置,检验性质,尾气吸收装置的顺序组装;
(2)A中为浓盐酸和二氧化锰的反应;
(3)先产生氯气,让氯气排净装置中的空气,然后开始氯气和铜的反应.
解答:
解:Ⅰ.(1)电解饱和食盐水的化学方程式是:2NaCl+2H2O
2NaOH+H2↑+Cl2↑,a电极为阴极,阴极上水电解出的氢离子放电,故导致氢离子浓度减小,氢氧根浓度增大,故该电极附近变红,故答案为:a;
(2)电解饱和食盐水的化学方程式是:2NaCl+2H2O
2NaOH+H2↑+Cl2↑,故答案为:2NaCl+2H2O
2NaOH+H2↑+Cl2↑;
(3)次氯酸不稳定,能分解生成氯化氢和氧气,即:2HClO
2HCl+O2↑,故答案为:2HClO
2HCl+O2↑;
II.(1)实验室用A装置制备氯气,气体分别通入盛有饱和氯化钠溶液的洗气瓶C和盛有浓硫酸的洗气瓶B,除杂干燥后通入装置E检验氯气和铜的反应,氯气有毒,不能直接排放到空气中,应用盛有NaOH溶液的装置C吸收;故答案为:ADBEC;
(2)化合价升高的Cl元素失2mol电子,化合价降低的Mn元素得到2mol电子,电子转移情况为: ,故每生成1mol氯气转移电子数为2mol,有2molHCl被氧化,标况下,2.24L氯气物质的量为0.1mol,故被氧化的HCl为0.2mol,
,故每生成1mol氯气转移电子数为2mol,有2molHCl被氧化,标况下,2.24L氯气物质的量为0.1mol,故被氧化的HCl为0.2mol,
故答案为: ;0.2;
;0.2;
(3)先点燃A处的酒精灯,开始产生氯气,直到生成的氯气充满整个装置,把空气排净,这时整个装置呈现黄绿色,再点燃E的酒精灯开始加热,使氯气和铜发生反应生成氯化铜,铜在氯气的环境中剧烈燃烧,产生棕黄色的氯化铜颗粒,固体颗粒为烟,脱脂棉的作用是防止固体冲出,阻塞导管,
故答案为:剧烈燃烧,产生棕黄色烟;防止固体冲出,阻塞导管.
| ||
(2)电解饱和食盐水的化学方程式是:2NaCl+2H2O
| ||
| ||
(3)次氯酸不稳定,能分解生成氯化氢和氧气,即:2HClO
| ||
| ||
II.(1)实验室用A装置制备氯气,气体分别通入盛有饱和氯化钠溶液的洗气瓶C和盛有浓硫酸的洗气瓶B,除杂干燥后通入装置E检验氯气和铜的反应,氯气有毒,不能直接排放到空气中,应用盛有NaOH溶液的装置C吸收;故答案为:ADBEC;
(2)化合价升高的Cl元素失2mol电子,化合价降低的Mn元素得到2mol电子,电子转移情况为:
 ,故每生成1mol氯气转移电子数为2mol,有2molHCl被氧化,标况下,2.24L氯气物质的量为0.1mol,故被氧化的HCl为0.2mol,
,故每生成1mol氯气转移电子数为2mol,有2molHCl被氧化,标况下,2.24L氯气物质的量为0.1mol,故被氧化的HCl为0.2mol,故答案为:
 ;0.2;
;0.2;(3)先点燃A处的酒精灯,开始产生氯气,直到生成的氯气充满整个装置,把空气排净,这时整个装置呈现黄绿色,再点燃E的酒精灯开始加热,使氯气和铜发生反应生成氯化铜,铜在氯气的环境中剧烈燃烧,产生棕黄色的氯化铜颗粒,固体颗粒为烟,脱脂棉的作用是防止固体冲出,阻塞导管,
故答案为:剧烈燃烧,产生棕黄色烟;防止固体冲出,阻塞导管.
点评:本题考查了氯气的实验室制法和氯气的性质,氧化还原反应的规律,题目难度中等,解题关键在于明确实验室制备氯气的原理和氯气的性质.

练习册系列答案
相关题目
下列气体中能用浓硫酸干燥的是( )
| A、H2S |
| B、NH3 |
| C、HI |
| D、CO2 |
98%的浓硫酸(密度为1.84g?cm-3)配制0.5mol?L-1的稀硫酸180mL,现给出下列仪器(配制过程中可能用到):①50mL量筒;②10mL量筒;③50mL烧杯;④托盘天平;⑤250mL容量瓶;⑥胶头滴管;⑦玻璃棒.配置过程一定需要使用的仪器是( )
| A、②③⑤⑥⑦ |
| B、③④⑤⑥⑦ |
| C、①②③⑤⑥⑦ |
| D、①③⑤⑥ |
下列溶剂能用来萃取溴水中的溴的是( )
| A、直馏汽油 | B、裂化汽油 |
| C、环己烯 | D、酒精 |