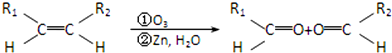
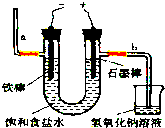
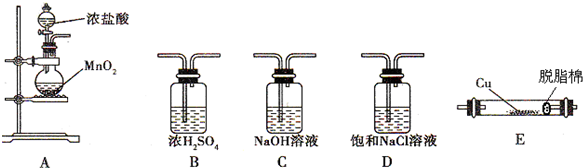
题目内容
98%的浓硫酸(密度为1.84g?cm-3)配制0.5mol?L-1的稀硫酸180mL,现给出下列仪器(配制过程中可能用到):①50mL量筒;②10mL量筒;③50mL烧杯;④托盘天平;⑤250mL容量瓶;⑥胶头滴管;⑦玻璃棒.配置过程一定需要使用的仪器是( )
| A、②③⑤⑥⑦ |
| B、③④⑤⑥⑦ |
| C、①②③⑤⑥⑦ |
| D、①③⑤⑥ |
考点:溶液的配制
专题:化学实验常用仪器
分析:先根据稀释前后溶质的物质的量不变,计算出浓溶液的体积,选取合适的量筒,再根据配制一定物质的量浓度的溶液需要量取、溶解、移液、洗涤、定容、摇匀等操作选取仪器解答.
解答:
解:98%的浓H2SO4的物资的量浓度为c=
=
=18.4mol/L,配制0.5mol/L的稀硫酸180mL,需要用250mL容量瓶,需要浓硫酸的体积为V=
=0.0068L,即6.8ml,应选择10ml量筒,实验时用10ml量筒量取6.8ml浓硫酸,然后在50mL烧杯中稀释浓硫酸,转移溶液需要玻璃棒,最后定容需要胶头滴管,所以配置过程一定需要使用的仪器为②③⑤⑥⑦,
故选A.
| 1000ρω |
| M |
| 1000×1.84×98% |
| 98 |
| 0.25L×0.5mol/L |
| 18.4mol/L |
故选A.
点评:本题主要考查了配制一定物质的量浓度溶液的操作步骤和使用仪器,难度不大,注意量筒的选择.

练习册系列答案
相关题目
某研究小组为测定食用白醋中醋酸的含量进行的如下操作,正确的是( )
| A、用碱式滴定管量取一定体积的待测白醋放入锥形瓶中 |
| B、称取4.0gNaOH到1000mL容量瓶加水至刻度,配成1.00 mol?L-1NaOH标准溶液 |
| C、用NaOH溶液滴定白醋,使用酚酞作指示剂,溶液颜色恰好由无色变为浅红色,且半分钟内不退色时,为滴定终点 |
| D、滴定时眼睛要注视着滴定管内NaOH溶液的液面变化,防止滴定过量 |
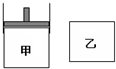 有两只密闭容器甲和乙.甲容器有一个可以移动的活塞能使容器内保持恒压,乙容器能保持恒容.起始时向这两个容器中分别充入等物质的量的体积比为2:1的M和N的混合气体,并使甲和乙容积相等(如右图所示).在保持400℃的条件下使之发生如下反应:2M(g)+N(g)?2Q(g),并达到平衡.下列说法正确的是( )
有两只密闭容器甲和乙.甲容器有一个可以移动的活塞能使容器内保持恒压,乙容器能保持恒容.起始时向这两个容器中分别充入等物质的量的体积比为2:1的M和N的混合气体,并使甲和乙容积相等(如右图所示).在保持400℃的条件下使之发生如下反应:2M(g)+N(g)?2Q(g),并达到平衡.下列说法正确的是( )| A、甲容器达到平衡时所需的时间比乙容器长 |
| B、平衡时甲容器中M的转化率比乙容器小 |
| C、平衡后,若向两容器中通入数量不多的等物质的量的氩气,甲容器中化学平衡向逆反应方向移动,乙容器中化学平衡不移动 |
| D、平衡后,若向两容器中通入等物质的量的原反应气体,达到平衡时,甲容器的混合气体中Q的体积分数变小,乙容器的混合气体中Q的体积分数增大 |
现欲粗略测定一未知浓度的醋酸溶液中CH3COOH的电离度,应做的实验和所需的试剂(或试纸)是( )
| A、电解、NaOH溶液 |
| B、蒸馏、Na2CO3溶液 |
| C、酯化反应、石蕊试液 |
| D、中和滴定、pH试纸 |
某温度下,在一固定体积的密闭容器中,进行如下化学反应:H2(g)+I2(g)?2HI(g),下列情况能说明该反应一定达到平衡状态的是( )
| A、混合气体的颜色不再改变 |
| B、混合气体的压强不再改变 |
| C、单位时间内拆开1 mol H-H键,同时生成2 mol H-I键 |
| D、混合气体的密度不再改变 |
据长沙晚报报道:长沙市的夜市小吃摊上有人在卖“纯人工鸡蛋”.国务院明确该食品存在安全隐患必须召回.人造鸡蛋所用的都是化学成分.人造鸡蛋的蛋壳是用碳酸钙做的,蛋黄和蛋清则是用海藻酸钠、明矾、明胶、食用氯化钙加水、色素等制成.下列判断正确的是( )
| A、“人造鸡蛋”蛋清在硫化铵、硫酸钠溶液中发生盐析,在硫酸铜溶液中变性 |
| B、“人造鸡蛋”在食醋中可能变软,有气泡产生 |
| C、长期食用“人造鸡蛋”可以补钙,强身健体 |
| D、“人造鸡蛋”长期放置会变质,有硫化氢生成 |