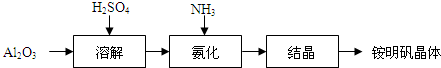
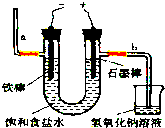
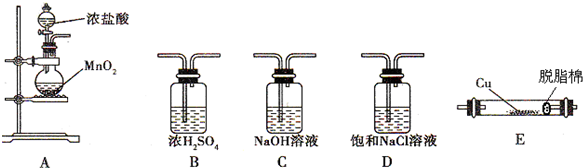
题目内容
将6mol A气体和5mol B气体混合放入4L密闭容器中,发生下列反应:3A (g)+B (g)?2C (g)+xD (g),经过5min达到化学平衡,此时生成C为2mol,测得D的反应速率为0.1mol/L?min,计算:
①x的值为 ;
②平衡常数K为 (精确到小数点后两位).
①x的值为
②平衡常数K为
考点:用化学平衡常数进行计算,化学反应速率和化学计量数的关系
专题:
分析:①根据D的反应速率求出D的物质的量,根据反应的物质的量之比等于化学计量数之比计算x;
②依据化学方程式计算平衡浓度,结合平衡常数概念是利用生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积得到.
②依据化学方程式计算平衡浓度,结合平衡常数概念是利用生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积得到.
解答:
解:①D的物质的量为n(D)=0.1mol?(L?min)-1×5min×4L=2mol,物质的量之比等于化学计量数之比,所以2:x=2mol:2mol,解得x=2,故答案为:2;
②平衡时生成C为2mol,D的平均反应速率为0.1mol/(L?min),生成D的物质的量为0.1mol/(L?min)×5min×4L=2mol,则:
3A(g)+B(g)?2C(g)+2D(g)
起始量(mol) 6 5 0 0
变化量(mol) 3 1 2 2
平衡量(mol) 3 4 2 2
反应平衡常数K=
=0.15,故答案为:0.15.
②平衡时生成C为2mol,D的平均反应速率为0.1mol/(L?min),生成D的物质的量为0.1mol/(L?min)×5min×4L=2mol,则:
3A(g)+B(g)?2C(g)+2D(g)
起始量(mol) 6 5 0 0
变化量(mol) 3 1 2 2
平衡量(mol) 3 4 2 2
反应平衡常数K=
| ||||
|
点评:本题考查了化学平衡常数的计算,注意对公式的理解与灵活运用、三段式应用,题目难度不大.

练习册系列答案
相关题目
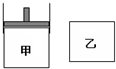 有两只密闭容器甲和乙.甲容器有一个可以移动的活塞能使容器内保持恒压,乙容器能保持恒容.起始时向这两个容器中分别充入等物质的量的体积比为2:1的M和N的混合气体,并使甲和乙容积相等(如右图所示).在保持400℃的条件下使之发生如下反应:2M(g)+N(g)?2Q(g),并达到平衡.下列说法正确的是( )
有两只密闭容器甲和乙.甲容器有一个可以移动的活塞能使容器内保持恒压,乙容器能保持恒容.起始时向这两个容器中分别充入等物质的量的体积比为2:1的M和N的混合气体,并使甲和乙容积相等(如右图所示).在保持400℃的条件下使之发生如下反应:2M(g)+N(g)?2Q(g),并达到平衡.下列说法正确的是( )| A、甲容器达到平衡时所需的时间比乙容器长 |
| B、平衡时甲容器中M的转化率比乙容器小 |
| C、平衡后,若向两容器中通入数量不多的等物质的量的氩气,甲容器中化学平衡向逆反应方向移动,乙容器中化学平衡不移动 |
| D、平衡后,若向两容器中通入等物质的量的原反应气体,达到平衡时,甲容器的混合气体中Q的体积分数变小,乙容器的混合气体中Q的体积分数增大 |
现欲粗略测定一未知浓度的醋酸溶液中CH3COOH的电离度,应做的实验和所需的试剂(或试纸)是( )
| A、电解、NaOH溶液 |
| B、蒸馏、Na2CO3溶液 |
| C、酯化反应、石蕊试液 |
| D、中和滴定、pH试纸 |
某温度下,在一固定体积的密闭容器中,进行如下化学反应:H2(g)+I2(g)?2HI(g),下列情况能说明该反应一定达到平衡状态的是( )
| A、混合气体的颜色不再改变 |
| B、混合气体的压强不再改变 |
| C、单位时间内拆开1 mol H-H键,同时生成2 mol H-I键 |
| D、混合气体的密度不再改变 |
已知:C(s)+O2(g)=CO2(g)△H1
CO2(g)+C(s)=2CO(g)△H2
2CO(g)+O2(g)=2CO2(g)△H3
4Fe(s)+3O2(g)=2Fe2O3(s)△H4
3CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s)△H5
下列关于上述反应焓变的判断正确的是( )
CO2(g)+C(s)=2CO(g)△H2
2CO(g)+O2(g)=2CO2(g)△H3
4Fe(s)+3O2(g)=2Fe2O3(s)△H4
3CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s)△H5
下列关于上述反应焓变的判断正确的是( )
| A、△H1>0,△H2>0 |
| B、△H3<0,△H4>0 |
| C、△H3=△H1-△H2 |
| D、△H4=2△H5-3△H3 |
2014年我国纪念“世界水日”活动的宣传主题为“加强河湖管理,建设水生态文明”.下列与水相关的叙述正确的是( )
| A、加聚反应也可能有水生成 |
| B、有水参加的有机化学反应都可以叫做水解反应 |
| C、水可以参与有些有机反应,有些有机反应也有水生成 |
| D、水、乙醇、氢氧化钠中都存在羟基 |