题目内容
(1)电石(CaC2)中C22-与N2互为等电子体,C22-的电子式可表示为 ;1molO22+中含有的π键数目为 .
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2.T的基数原子外围电子(价电子)排布为 ,Q2+的未成对电子数是 .
(3)已知MgF2、NaF的熔点分别为1534K、1266K,其结果表明MgF2的离子键强度 (填“>”、“<”或“=”)NaF的离子键强度.
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2.T的基数原子外围电子(价电子)排布为
(3)已知MgF2、NaF的熔点分别为1534K、1266K,其结果表明MgF2的离子键强度
考点:共价键的形成及共价键的主要类型,原子核外电子排布,用晶格能的大小衡量离子晶体中离子键的强弱
专题:原子组成与结构专题,化学键与晶体结构
分析:(1)C22-含有C≡C键,等电子体的结构相似,故O22+与C22-相似,含有2个π键;
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,则Q、T处于第Ⅷ族,且原子序数T比Q多2,则Q为Fe元素,T为Ni元素,再结合核外电子排布规律解答;
(3)离子键强度越大,离子晶体的熔点越高.
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,则Q、T处于第Ⅷ族,且原子序数T比Q多2,则Q为Fe元素,T为Ni元素,再结合核外电子排布规律解答;
(3)离子键强度越大,离子晶体的熔点越高.
解答:
解:(1)C22-含有C≡C键,电子式为 ,等电子体的结构相似,故O22+的电子式与C22-的电子式相似,含有2个π键,
,等电子体的结构相似,故O22+的电子式与C22-的电子式相似,含有2个π键,
故答案为: ;2;
;2;
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,则Q、T处于第Ⅷ族,且原子序数T比Q多2,则Q为Fe元素,T为Ni元素,Ni元素是28号元素,Ni原子价电子排布式为3d84s2,Fe2+的核外电子排布式为1s24s22p63s23d6,3d能级有4个单电子,
故答案为:3d84s2;4;
(3)离子键强度越大,离子晶体的熔点越高,MgF2、熔点较高,说明离子键强度较大,故答案为:>.
 ,等电子体的结构相似,故O22+的电子式与C22-的电子式相似,含有2个π键,
,等电子体的结构相似,故O22+的电子式与C22-的电子式相似,含有2个π键,故答案为:
 ;2;
;2;(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,则Q、T处于第Ⅷ族,且原子序数T比Q多2,则Q为Fe元素,T为Ni元素,Ni元素是28号元素,Ni原子价电子排布式为3d84s2,Fe2+的核外电子排布式为1s24s22p63s23d6,3d能级有4个单电子,
故答案为:3d84s2;4;
(3)离子键强度越大,离子晶体的熔点越高,MgF2、熔点较高,说明离子键强度较大,故答案为:>.
点评:本题考查较为综合,涉及电子式、元素周期表、核外电子排布,为高频考点,侧重于基本概念、基本理论知识的综合理解和运用的考查,难度不大,注意相关知识的积累.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
水的电离平衡曲线如图所示,下列说法不正确的是( )


| A、图中五点KW间的关系:B>C>A=D=E |
| B、若从A点到D点,可采用:温度不变时在水中加入少量酸 |
| C、在B点对应的温度下,将pH=2的硝酸与pH=10的Ba(OH)2(aq)等体积混合后,溶液显中性 |
| D、若从A点到C点,可采用:温度不变时在水中加入适量的NH4Cl固体 |
有体积相同,pH相等的烧碱溶液和氨水,下列叙述中正确的是( )
| A、两溶液溶质物质的量浓度相同 |
| B、用同浓度的盐酸中和时,消耗盐酸的体积相同 |
| C、两溶液中OH-离子浓度相同 |
| D、加入等体积的水稀释后,它们的pH仍相等 |
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如下图为N2(g)相 O2(g)反应生成NO(g)过程中的能量变化:下列说法正确的是( )


| A、1mol N2(g)和1molO2(g)具有的总能量大于 2mol NO(g)具有的总能量 |
| B、1molN2(g)和lmolO2(g)反应生成2molNO(g)吸收180 kJ热量 |
| C、通常情况下N2(g)和O2(g)混合能直接反应生成NO |
| D、数据不足,不能确定反应热的大小 |
下列反应的离子方程式正确的是( )
A、苯酚与碳酸钠溶液的反应 |
| B、等体积、等浓度的Ca(HCO3)2和NaOH溶液混合Ca2++2HCO3-+2OH-→CaCO3↓+CO32-+2H20 |
| C、硫化亚铁溶于稀硝酸中:FeS+2H+=Fe2++H2S↑ |
| D、淀粉碘化钾溶液在空气中变蓝2I-+O2+H2O=I2+2OH- |
下列说法正确的是( )
| A、不能跟碱反应的氧化物一定能和酸反应 |
| B、溶液和胶体的本质区别在于分散质粒子的直径大小不同 |
| C、58.5gNaCl固体溶于1L水所得溶液中NaCl的物质的量浓度为l mol?L-1 |
| D、将SO2通入滴有酚酞的NaOH溶液中,溶液红色消失,说明SO2具有漂白性 |
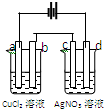 如图的电解池中,a、b、c、d都是石墨电极,通电一段时间后,a、b、c、d各电极上生成物物质的量之比是( )
如图的电解池中,a、b、c、d都是石墨电极,通电一段时间后,a、b、c、d各电极上生成物物质的量之比是( )| A、2:2:4:1 |
| B、1:1:2:1 |
| C、2:4:4:1 |
| D、2:1:2:1 |
对氯化铁溶液和氢氧化铁胶体的说法正确的是( )
| A、分散系颗粒直径都在1~100nm之间 |
| B、能透过半透膜 |
| C、呈红褐色 |
| D、用丁达尔效应可以鉴别 |
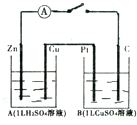 如图装置闭合电键时,电流计A的指针将发生偏转,试回答下列问题.
如图装置闭合电键时,电流计A的指针将发生偏转,试回答下列问题.