题目内容
水的电离平衡曲线如图所示,下列说法不正确的是( )


| A、图中五点KW间的关系:B>C>A=D=E |
| B、若从A点到D点,可采用:温度不变时在水中加入少量酸 |
| C、在B点对应的温度下,将pH=2的硝酸与pH=10的Ba(OH)2(aq)等体积混合后,溶液显中性 |
| D、若从A点到C点,可采用:温度不变时在水中加入适量的NH4Cl固体 |
考点:离子积常数
专题:
分析:A、ADE都处于250C时,Kw相等,然后比较B、E两点的c(H+)和c(OH-)的大小,依次比较Kw的大小;
B、从A点到D点c(H+)变大,但c(OH-)变小,温度不变,Kw不变;
C、根据B点时Kw计算酸与碱溶液中c(H+)和c(OH-),然后判断溶液的酸碱性;
D、从A点到C点c(H+)和c(OH-)的变化判断Kw的变化,依次判断温度的变化.
B、从A点到D点c(H+)变大,但c(OH-)变小,温度不变,Kw不变;
C、根据B点时Kw计算酸与碱溶液中c(H+)和c(OH-),然后判断溶液的酸碱性;
D、从A点到C点c(H+)和c(OH-)的变化判断Kw的变化,依次判断温度的变化.
解答:
解:A、ADE都处于250C时,Kw相等,B点c(H+)和c(OH-)都大于E点的c(H+)和c(OH-),并且C点的c(H+)和c(OH-)大于A点c(H+)和c(OH-),c(H+)和c(OH-)越大,Kw越大,故B>C>A=D=E,故A正确;
B、加酸,c(H+)变大,但c(OH-)变小,但温度不变,Kw不变,故B正确;
C、若处在B点时,Kw=1×10-12,pH=2的硫酸中c(H+)=10-2mol/L,pH=10的KOH中c(OH-)=10-2mol?L-1,等体积混合,恰好中和,溶液显中性,故C正确;
D、若从A点到C点,c(H+)变大,c(OH-)变大,Kw增大,温度应升高,故D错误,故选D.
B、加酸,c(H+)变大,但c(OH-)变小,但温度不变,Kw不变,故B正确;
C、若处在B点时,Kw=1×10-12,pH=2的硫酸中c(H+)=10-2mol/L,pH=10的KOH中c(OH-)=10-2mol?L-1,等体积混合,恰好中和,溶液显中性,故C正确;
D、若从A点到C点,c(H+)变大,c(OH-)变大,Kw增大,温度应升高,故D错误,故选D.
点评:本题考查水的电离平衡移动问题,结合图象判断并分析溶液在不同温度下的Kw,做题时注意根据图象比较c(H+)和c(OH-)的大小.

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案
相关题目
常温时,向pH=12的Ba(OH)2溶液中加入等体积的下列溶液后,滴入酚酞试液出现红色,该溶液应该是( )
| A、pH=2的硫酸溶液 |
| B、pH=2的醋酸溶液 |
| C、0.05mol/L盐酸溶液 |
| D、0.05mol/LNa2SO4溶液 |
0.1mol/L氨水和0.1mol/L盐酸等体积混合后,溶液中离子浓度大小顺序正确的是( )
| A、c(Cl-)>c(H-)>c(NH4+)>c(OH-) |
| B、c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| C、c(Cl-)>c(OH-)>c(NH4+)>c(H+) |
| D、c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
升高温度,下来物理量不一定增大的是( )
| A、化学反应中的反应速率 |
| B、水的离子积常数 |
| C、化学平衡常数 |
| D、弱酸的电离平衡常数 |
在一定条件下发生下列反应,其中属于盐类水解反应的是( )
| A、HS-+H+═H2S |
| B、HCO3-+H2O?H3O++CO32- |
| C、NH4++H2O?NH3?H2O+H+ |
| D、Cl2+H2O?H++Cl-+HClO |
关于下列装置说法正确的是( )
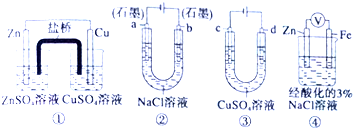

| A、装置①中,盐桥中的K+移向ZnSO4溶液 |
| B、用装置③精炼铜时,c极为粗铜 |
| C、装置②工作一段时间后,a极附近溶液的pH增大 |
| D、装置④中电子Zn流向Fe,装置中有Fe2+生成 |
下列有关人体发胖的说法不科学的是( )
| A、人体发胖是脂肪在人体中的积累 |
| B、葡萄糖在酶催化下经过一系列反应也能在体内转化为脂肪 |
| C、胖子们说自己光喝水也会发胖 |
| D、过量食用酸性食物易引起发胖 |
下列有关环境、健康、发展的叙述中,不正确的是( )
| A、可吸入颗粒(例如硅酸盐粉尘)形成溶胶,对人类健康危害极大 |
| B、开发利用绿色能源替代化石燃料是人类可持续发展的必由之路 |
| C、装修材料中的苯、甲醛主要来自于胶水、油漆等,严重损害健康 |
| D、PM2.5、CO2、氟氯烃含量都是空气质量报告的主要项目之一 |