题目内容
15. 氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用.
氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用.(1)基态砷原子的电子排布式为1s22s22p63s23p63d104s24p3.
(2)K3[Fe(CN)5]晶体中Fe3+与CN-之间的化学键类型为配位键,与CN-互为等电子体的化合物的分子式为CO.
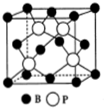
(3)氮化硼(BN)有多种晶型,其中立方氮化硼与金刚石的构型类似,则其晶胞中B-N-B之间的夹角是109°28′(填角度).
(4)对硝基苯酚水合物(化学式为C4H5NO3•1.5H2O)是一种含氮化合物.实验表明:加热至94℃时该晶体会失去结晶水,由黄色变成鲜亮的红色,在空气中温度降低又变为黄色,具有可逆热色性.
①该晶体中四种基本元素的电负性由大到小的顺序是O>N>C>H.
②对硝基苯酚分子中氮原子的杂化轨道类型是sp2杂化.
(5)磷化硼(BP)是一种有价值的耐磨硬涂层材料,这种陶瓷材料可作为金属表面的保护薄膜,它是通过在高温(T>750℃)氢气氛围下三溴化硼和三溴化磷反应制得的,三溴化硼分子的空间构型为平面三角形,BP晶胞的结构如图所示,当晶胞晶格参数为478pm(即图中立方体的每条边长为478pm)时,磷化硼中硼原子和磷原子之间的最近距离为119.5$\sqrt{3}$pm.
分析 (1)As的原子序数为33,根据构造原理书写其基态原子核外电子排布式;
(2)当中心原子有空轨道,配离子含有孤对电子时,能形成配位键;根据等电子体原理可写出与CN-互为等电子体的化合物分子式;
(3)立方氮化硼与金刚石的构型类似,金刚石为正四面体结构,键角为109°28′,则其晶胞中B-N-B之间的夹角是109°28′;
(4)①同周期自左而右元素电负性增大,元素的非金属性越强其电负性越强;
②对硝基苯酚分子结构简式为 ,根据杂化轨道理论分析氮原子的杂化;
,根据杂化轨道理论分析氮原子的杂化;
(5)根据杂化轨道理论分析硼原子的价层电子对数判断分子构型;根据磷化硼的晶体结构解答其化学式;P原子与周围的4个B原子最近且形成正四面体结构,二者连线处于体对角线上,磷化硼中硼原子和磷原子之间的最近距离为体对角线的$\frac{1}{4}$.
解答 解:(1)As的原子序数为33,基态原子的电子排布式为1s22s22p63s23p63d104s24p3,
故答案为:1s22s22p63s23p63d104s24p3;
(2)K3[Fe(CN)6]晶体中Fe3+与CN-之间的化学键类型为配位键,Fe3+有空轨道,能接受孤对电子,CN-能提供孤对电子,所以能形成配位键,原子数目相等、价电子数目相等的微粒互为等电子体,与CN-互为等电子体的化合物分子式为CO,
故答案为:配位; CO;
(3)立方氮化硼与金刚石的构型类似,金刚石为正四面体结构,键角为109°28′,则其晶胞中B-N-B之间的夹角是109°28′,
故答案为:109°28′;
(4)①元素的非金属性越强其电负性越强,O、N、C、H的非金属性逐渐减弱,所以O、N、C、H的电负性逐渐减弱,则O、N、C、H的电负性由大到小的顺序是O>N>C>H,
故答案为:O>N>C>H;
②对硝基苯酚分子结构简式为 ,氮原子形成3个σ键、2个π键,没有孤对电子,所以是sp2杂化,
,氮原子形成3个σ键、2个π键,没有孤对电子,所以是sp2杂化,
故答案为:sp2杂化;
(5)三溴化硼分子中硼原子的价层电子对数为$\frac{3+3}{2}$=3,B原子按sp2方式杂化,没有孤电子对,所以分子空间构型为平面三角形,由图可知,B原子分别与三个P原子形成共价键,则磷化硼的化学式为BP,P原子与周围的4个B原子最近且形成正四面体结构,二者连线处于体对角线上,为体对角线的$\frac{1}{4}$,立方体的每条边长为478pm,则晶胞体对角线长为$\sqrt{3}$×478pm,则P原子与B原子最近距离为$\sqrt{3}$×478×$\frac{1}{4}$pm=119.5$\sqrt{3}$pm,
故答案为:平面三角形;119.5$\sqrt{3}$pm.
点评 本题考查物质的结构与性质,注重对电子排布式、化学键类型、杂化理论的应用、晶体结构考查,考查点较多,题目难度中等,侧重考查学生对知识的迁移应用,注意信息的理解和综合应用.

 名校课堂系列答案
名校课堂系列答案| A. | 纤维素 | B. | 蛋白质 | C. | 聚乙烯 | D. | 淀粉 |
| A. | 当△H为负值时,表示该反应为吸热反应 | |
| B. | 反应热的大小只与反应体系的始态和终态有关 | |
| C. | 反应热的大小与反应物所具有的能量和生成物具有的能量无关 | |
| D. | 热化学方程式2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1,表示2 L氢气和1 L氧气反应放出571.6 kJ的热量 |
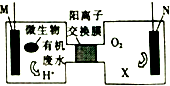 为解决淀粉厂废水中BOD严重超标的问题,有人设计了电化学降解法.如图是利用一种微生物将有机物将废水中有机物[主要成分是(C6H10O5)n]的化学能转化为电能的装置,下列说法中正确的是( )
为解决淀粉厂废水中BOD严重超标的问题,有人设计了电化学降解法.如图是利用一种微生物将有机物将废水中有机物[主要成分是(C6H10O5)n]的化学能转化为电能的装置,下列说法中正确的是( )| A. | N极是负极 | |
| B. | 该装置工作时,H+从右侧经阳离子交换膜移向左侧 | |
| C. | 负极的电极反应为:(C6H10O5)n+7H2O-24ne-═6nCO2↑+24nH+ | |
| D. | 物质X是OH- |
| A. | CH3-CH═CH2与C2H4 | B. | CH3COOCH3与CH3CH2COOCH3 | ||
| C. | 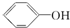 与 与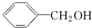 | D. | CH3CH2Cl与CH3CHClCH3 |
 .
.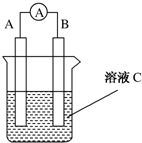 如图所示是原电池的装置图(
如图所示是原电池的装置图( 为电流表).请回答:
为电流表).请回答: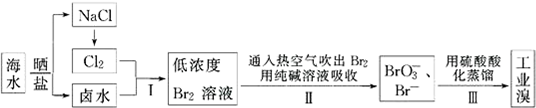
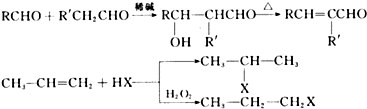


 .W有多种同分异构体,其中:①分子中有苯环,且苯环上的一溴代物有两种;②其水溶液遇FeCl3溶液呈紫色.则其可能的结构简式为(写两种):
.W有多种同分异构体,其中:①分子中有苯环,且苯环上的一溴代物有两种;②其水溶液遇FeCl3溶液呈紫色.则其可能的结构简式为(写两种): 、
、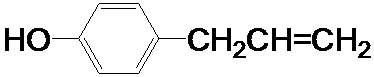
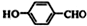 为原料制取液晶材料的中间体
为原料制取液晶材料的中间体  的合成路线图.
的合成路线图.