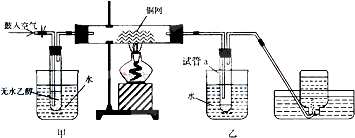
题目内容
4.我国有广阔的海岸线,海水综合利用大有可为.海水中Br-含量为65mg•L-1,从海水中提取溴的工业流程如下: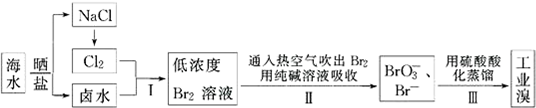
(1)以上步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将之转变成化合态的溴,其目的是:富集溴元素.
(2)步骤Ⅱ通入热空气或水蒸气吹出Br2,利用了溴的C(填序号).
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(3)以上流程Ⅱ中涉及的离子反应如下,请在下面方框内填入适当的化学计量数:
3Br2+3CO32-═1BrO3-+5Br-+3CO2↑
(4)上述流程中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏.写出溴蒸气与二氧化硫水溶液反应的离子方程式:SO2+Br2+2H2O=4H++2Br-+SO42-;.
(5)实验室从溴水中分离出溴还可以用溶剂萃取法,下列可以用作溴的萃取剂的是BD(填序号).
A.乙醇 B.四氯化碳 C.裂化汽油 D.苯
(6)用上述流程制得含Br265%的工业溴1t,至少需要海水2.0×104m3.
(7)上述流程中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏.写出溴与二氧化硫水溶液反应的离子方程式:SO2+Br2+2H2O=4H++2Br-+SO42-.
分析 根据流程分析可知:海水通过晒盐得到氯化钠和卤水,卤水加入氧化剂氯气氧化溴离子为单质溴,得到低浓度Br2的溶液,通入热空气或水蒸气吹出Br2,用纯碱溶液吸收得到含Br-和BrO3-的混合溶液,再利用酸溶液中溴酸根离子和溴离子发生氧化还原反应得到溴单质,蒸馏利用的是溴单质的易挥发性,
(1)步骤Ⅰ中已获得游离态的溴浓度很低,步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将之转变成化合态的溴,其目的是富集溴元素;
(2)溴单质具有易挥发性;
(3)根据反应物、生成物,结合转移电子守恒、原子守恒配平方程式;
(4)溴具有强氧化性、二氧化硫具有还原性,二者在水溶液中混合易发生氧化还原生成氢溴酸和硫酸;
(5)萃取剂的选取标准:萃取剂和溶质不反应、溶质在萃取剂中的溶解度大于在原溶剂中的溶解度、萃取剂和原溶剂不互溶;
(6)用上述流程制得含Br265%的工业溴1t,计算含溴离子的质量,海水中Br-含量为65mg•L-1,计算得到海水的体积,注意单位换算;
(7)溴具有强氧化性、二氧化硫具有还原性,二者在水溶液中混合易发生氧化还原生成氢溴酸和硫酸.
解答 解:(1)步骤Ⅰ中已获得游离态的溴浓度很低,如果直接蒸馏,生产成本较高,不利于工业生产,步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将之转变成化合态的溴,其目的是富集溴元素,降低成本,
故答案为:富集溴元素;
(2)溴易挥发,步骤Ⅱ通入热空气或水蒸气吹出Br2,就是利用溴的挥发性,故选C,
故答案为:C;
(3)该反应中Br元素化合价由0价变为-1价、+5价,其最小公倍数是5,再结合原子守恒或电荷守恒得方程式为3Br2+3CO32-═BrO3-+5Br-+3CO2↑,
故答案为:3;3;1;5;3;
(4)上述流程中吹出的溴蒸气,也可以用二氧化硫水溶液吸收,再用氯气氧化后蒸馏.溴与二氧化硫水溶液反应生成硫酸和溴化氢,反应的化学方程式为:Br2+SO2+2H2O=2HBr+H2SO4,离子方程式:SO2+Br2+2H2O=4H++2Br-+SO42-,
故答案为:SO2+Br2+2H2O=4H++2Br-+SO42-;
(5)萃取剂的选取标准:萃取剂和溶质不反应、溶质在萃取剂中的溶解度大于在原溶剂中的溶解度、萃取剂和原溶剂不互溶,
A.乙醇易溶于水,所以不能作萃取剂,故A错误;
B.四氯化碳符合萃取剂选取标准,所以能作萃取剂,故B正确;
C.裂化汽油和溴能发生加成反应,所以不能作萃取剂,故C错误;
D.苯符合萃取剂选取标准,所以能作萃取剂,故D正确;
故答案为:BD;
(6)用上述流程制得含Br265%的工业溴1t,含溴元素质量=1t×65%×2=1.3t=1.3×109mg,海水中Br-含量为65mg•L-1,溴元素守恒,则海水的体积=$\frac{1.3×1{0}^{-9}mg}{65mg/L}$=2.0×107L=2.0×104m3,
故答案为:2.0×104;
(7)溴具有强氧化性、二氧化硫具有还原性,二者在水溶液中混合易发生氧化还原生成氢溴酸和硫酸,反应的离子方程式为:SO2+Br2+2H2O=4H++2Br-+SO42-,
故答案为:SO2+Br2+2H2O=4H++2Br-+SO42-.
点评 本题考查了海水资源的综合利用,涉及萃取剂的选取、氧化还原反应、方程式的配平等知识点,从整体上分析流程,知道每一步可能发生的反应及基本操作,再结合基本概念、基本理论是解答关键,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | CH3CH(CH3)2属于链状化合物 | B. |  属于芳香族化合物 属于芳香族化合物 | ||
| C. |  属于脂环化合物 属于脂环化合物 | D. |  属于芳香化合物 属于芳香化合物 |
| A. | 2.5 mol | B. | 2 mol | C. | 1.25 mol | D. | 0.5 mol |
| A. | Na+ | B. | F- | C. | Al3+ | D. | S2- |
| A. | 15:8:1 | B. | 13:6:1 | C. | 9:6:1 | D. | 6:3:1 |
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是b.
a.原子序数和离子半径均减小 b.金属性减弱,非金属性增强
c.氧化物对应的水合物碱性减弱,酸性增强 d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为氩
(3)已知:
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |
(4)晶体硅(熔点1410℃)是良好的半导体材料.由粗硅制纯硅过程如下:
Si(粗)$→_{460}^{Cl_{2}}$SiCl4$\stackrel{蒸馏}{→}$SiCl4(纯)$→_{1100℃}^{H_{2}}$Si(纯)
写出SiCl4的电子式:
 ;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,该反应的热化学方程式:SiCl4(g)+2H2(g)$\frac{\underline{\;高温\;}}{\;}$Si(s)+4HCl(g)△H=-0.025kJ/mol
;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,该反应的热化学方程式:SiCl4(g)+2H2(g)$\frac{\underline{\;高温\;}}{\;}$Si(s)+4HCl(g)△H=-0.025kJ/mol(5)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的b:
a. NH3 b. HI c. SO2 d. CO2
(6)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1.写出该反应的化学方程式:4KClO3$\frac{\underline{\;400℃\;}}{\;}$KCl+3KClO4.
| A. | 医用酒精的浓度通常为95% | B. | 用食醋可除去热水壶内壁的水垢 | ||
| C. | 烹鱼时加适量醋和酒可以增加香味 | D. | 乙烯可作为水果的催熟剂 |
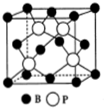 氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用.
氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用.