题目内容
9.在Fe+4HNO3(稀)═Fe(NO3)3+NO↑+2H2O的反应中,HNO3表现了强氧化性和酸性,则1mol Fe参加反应时,被还原的HNO3为1mol,转移电子3mol.分析 Fe+4HNO3(稀)═Fe(NO3)3+NO↑+2H2O中,Fe元素的化合价升高,N元素的化合价降低,且1molFe失去电子与1molHNO3得到电子相等,以此来解答.
解答 解:生成NO体现硝酸的强氧化性,生成硝酸铁体现硝酸的酸性,1mol Fe参加反应时,被还原的HNO3为$\frac{1mol×3}{(5-2)}$=1mol,转移电子为1mol×(3-0)=3mol,
故答案为:强氧化;酸;1;3.
点评 本题考查氧化还原反应及计算,为高频考点,把握反应中元素的化合价变化、转移电子计算为解答的关键,侧重分析与应用能力的考查,注意硝酸的作用,题目难度不大.

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案
相关题目
19.下列物质性质的变化规律与分子间作用力有关的是( )
| A. | HF、HCl、HBr、HI热稳定性依次减弱 | |
| B. | NaF、NaCl、NaBr、NaI的熔点依次降低 | |
| C. | 金刚石的硬度大于硅,其熔、沸点也高于硅 | |
| D. | F2、Cl2、Br2、I2的熔、沸点逐渐升高 |
20.某烃的衍生物A,其分子式为C6H12O2,实验表明A和NaOH溶液共热生成B和C,B和盐酸反应生成有机物D,C在铜催化作用和加热条件下氧化为E,其中D能发生银镜反应而E不能.由此判断A的可能结构有( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
1.下列各组物质,不属于同素异形体的是( )
| A. | 金刚石和石墨 | B. | 白磷和红磷 | C. | Na2O和Na2O2 | D. | 氧气和臭氧 |
18.下列化学用语和描述均正确的是( )
| A. | 结构示意图为 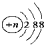 的阴离子都不能破坏水的电离平衡 的阴离子都不能破坏水的电离平衡 | |
| B. | 球棍模型为  的分子可发生加成反应 的分子可发生加成反应 | |
| C. | 邻硝基甲苯的结构简式为 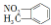 ,能发生取代反应 ,能发生取代反应 | |
| D. | 电子式分别为  和 和 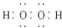 的两种化合物均为常见的氧化剂 的两种化合物均为常见的氧化剂 |


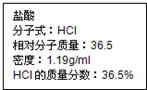 如图为实验室某盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题: