题目内容
19.分子数为1.806×1023的CO和CO2混合气体10g,其CO和CO2的物质的量之比为2:1,O的物质的量为0.4mol.分析 设出CO和CO2的物质的量,根据n=$\frac{N}{{N}_{A}}$计算出二者的总物质的量,分别根据物质的量、质量列式计算,然后可计算出CO和CO2的物质的量之比及O的物质的量.
解答 解:分子数为1.806×1023的CO和CO2混合气体的物质的量为:$\frac{1.806×1{0}^{23}}{6.02×1{0}^{23}}$mol=0.3mol,
设CO、CO2的物质的量分别为x、y,
则:$\left\{\begin{array}{l}{28x+44y=10}\\{x+y=0.3}\end{array}\right.$,
解得:$\left\{\begin{array}{l}{x=0.2mol}\\{y=0.1mol}\end{array}\right.$
所以CO和CO2的物质的量之比=0.2mol:0.1mol=2:1,
O的物质的量为:0.2mol×1+0.1mol×2=0.4mol,
故答案为:2:1;0.4mol.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量与阿伏伽德罗常数、摩尔质量之间的关系即可解答,试题侧重基础知识的考查,有利于提高学生的化学计算能力.

练习册系列答案
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案
相关题目
10.下列实验操作正确的是( )
| A. | 粗盐提纯蒸发时,待水分完全蒸干后停止加热 | |
| B. | 过滤时,漏斗下口尖端紧贴烧杯内壁 | |
| C. | 蒸馏时,冷却水应从冷凝管上口进下口出 | |
| D. | 分液操作时,上层液体应从分液漏斗下口放出 |
14.用NA表示阿伏加德罗常数,下列说法中正确的是( )
| A. | 12 g石墨和C60的混合物中质子总数为6NA | |
| B. | 常温下,4g 14CH4含有NA个C-H共价键 | |
| C. | 25℃时,pH=12的1.0 L NaClO溶液中水电离出的OH-的数目为0.01NA | |
| D. | 0.1 mol•L-1 Na2CO3溶液中含有0.1NA个CO32- |
4.在溶液中加入足量的Na2O2后仍能大量共存的离子组是( )
| A. | Na+、Fe2+、Cl-、SO42- | B. | K+、CO32-、Cl-、SO42- | ||
| C. | Ca2+、Mg2+、NO3-、HCO3- | D. | Na+、Cl-、CO32-、Fe3+ |
2.加热固体试剂时,不能使用的仪器是( )
| A. | 试管 | B. | 集气瓶 | C. | 蒸发皿 | D. | 坩埚 |
20.下列说法正确的是( )
| A. | 硫酸工业中涉及的3步反应都为氧化还原反应 | |
| B. | 由反应:H2S+Cl2═S↓+2HCl可知,还原性:Cl2>S | |
| C. | 如用NaOH溶液来吸收尾气中的SO2,只能生成一种盐 | |
| D. | 常温下,铝质容器或铁质容器可储运浓硫酸和浓硝酸 |
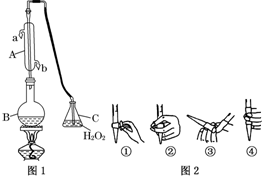 中华人民共和国国家标准(GB2760-2011)规定葡萄酒中SO2最大使用量为0.25g•L-1.某兴趣小组用图1装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定.
中华人民共和国国家标准(GB2760-2011)规定葡萄酒中SO2最大使用量为0.25g•L-1.某兴趣小组用图1装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定.