题目内容
12.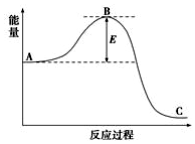 工业合成氨N2(g)+3H2(g)?2NH3(g)反应过程中的能量变化如下图所示,据图回答下列问题:
工业合成氨N2(g)+3H2(g)?2NH3(g)反应过程中的能量变化如下图所示,据图回答下列问题:(1)该反应通常用活性铁作催化剂,加活性铁会使图中B点降低(填“升高”还是“降低”),理由是催化剂改变了反应的历程使活化能E降低.
(2)该反应平衡常数表达式为:K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2}){c}^{3}({H}_{2})}$,增大氮气的量,K不变(填“增大”、“减小”、“不变”,下同).
(3)一定条件下的密闭容器中,该反应达到平衡,要提高N2的转化率,可以采取的合理措施有de(填字母代号).
a.高压 b.加入催化剂 c.增加N2的浓度 d.增加H2的浓度 e.分离出NH3.
分析 (1)催化剂是通过降低反应的活化能来加快化学反应速率;
(2)化学平衡常数是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,且只受温度的影响;
(3)要提高N2的转化率,应使平衡向正向移动,以此解答.
解答 解:(1)催化剂是通过降低反应的活化能来加快化学反应速率,所以加活性铁会使图中B点降低,故答案为:降低;催化剂改变了反应的历程使活化能E降低;
(2)合成氨的平衡常数表达式K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2}){c}^{3}({H}_{2})}$,平衡常数只受温度的影响,增大氮气的量,平衡常数不变,故答案为:$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2}){c}^{3}({H}_{2})}$;不变;
(3)一定条件下的密闭容器中,该反应达到平衡,要提高H2的转化率,即让化学平衡正向进行即可,一般不考虑加压,可以增加反应物H2的浓度、分离出NH3(减小生成物的浓度),高温条件会使平衡向左进行,加入催化剂不会改变反应物的转化率,增加N2的浓度会使得气氮气的转化率减小;
故答案为:de.
点评 本题考查较为综合,涉及化学平衡的移动,化学反应中能量变化等知识,为高频考点,侧重考查学生的分析能力,题目难度中等,注意把握平衡常数的意义.

练习册系列答案
 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案
相关题目
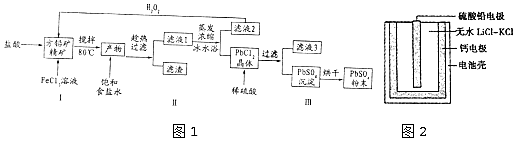
19.硫酸铅(PbSO4)广泛应用于制造铅蓄电池、白色颜料等.利用方铅矿精矿( PbS)直接制备硫酸铅粉末的流程如图1:
已知:(i) PbCl2 (s)+2C1-(aq)═PbCl42-(aq)△H>0
(ii)有关物质的Ksp和沉淀时的pH如表:
(1)步骤I反应加入盐酸后可以观察到淡黄色沉淀生成,请写出的离子方程式PbS+2Fe3++2Cl-=PbCl2+2Fe2++S↓.
(2)用化学平衡移动的原理解释步骤Ⅱ中使用冰水浴的原因用冰水浴使吸热反应PbCl2(s)+2Cl-(aq)?PbCl4-(aq)逆向移动,使PbCl4-不断转化为PbCl2晶体而析出.
(3)在上述生产过程中可以循环利用的物质有FeCl3和盐酸.
(4)写出步骤Ⅲ中PbCl2晶体转化为PbSO4沉淀的离子方程式PbCl2(s)+SO42-(aq)?PbSO4(s)+2Cl-(aq).
(5)PbSO4热激活电池可用作火箭、导弹的工作电源.基本结构如图2所示,其中作为电解质的无水LiCl-KC1混合物受热熔融后,电池即可瞬间输出电能.该电池总反应为PbSO4+2LiCl+Ca═CaCl2+Li2SO4+Pb.
①放电过程中,Li+向正极移动(填“负极”或“正极”).
②负极反应式为Ca+2Cl--2e-═CaCl2.
③电路中每转移0.2mol电子,理论上生成20.7g Pb.

已知:(i) PbCl2 (s)+2C1-(aq)═PbCl42-(aq)△H>0
(ii)有关物质的Ksp和沉淀时的pH如表:
| 物质 | Ksp | 物质 | 开始沉淀时pH | 完全沉淀时pH |
| PbSO4 | 1.0×10-8 | Fe(OH)3 | 2.7 | 3.7 |
| PbCl2 | 1.6×10-5 | Fe(OH)2 | 6 | 7.04 |
(2)用化学平衡移动的原理解释步骤Ⅱ中使用冰水浴的原因用冰水浴使吸热反应PbCl2(s)+2Cl-(aq)?PbCl4-(aq)逆向移动,使PbCl4-不断转化为PbCl2晶体而析出.
(3)在上述生产过程中可以循环利用的物质有FeCl3和盐酸.
(4)写出步骤Ⅲ中PbCl2晶体转化为PbSO4沉淀的离子方程式PbCl2(s)+SO42-(aq)?PbSO4(s)+2Cl-(aq).
(5)PbSO4热激活电池可用作火箭、导弹的工作电源.基本结构如图2所示,其中作为电解质的无水LiCl-KC1混合物受热熔融后,电池即可瞬间输出电能.该电池总反应为PbSO4+2LiCl+Ca═CaCl2+Li2SO4+Pb.
①放电过程中,Li+向正极移动(填“负极”或“正极”).
②负极反应式为Ca+2Cl--2e-═CaCl2.
③电路中每转移0.2mol电子,理论上生成20.7g Pb.
3.下列说法正确的是( )
| A. | 常温常压下,22.4L Cl2中含有的分子数为6.02×1023个 | |
| B. | 0.1mol/LNa2CO3溶液加热后,溶液的pH减小 | |
| C. | 氢氧燃料电池工作时,H2在负极上失去电子 | |
| D. | 室温下,稀释0.1mol/LCH3COOH溶液,溶液的导电能力增强 |
2.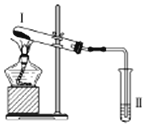 按如图装置进行实验,下列推断正确的是( )
按如图装置进行实验,下列推断正确的是( )
 按如图装置进行实验,下列推断正确的是( )
按如图装置进行实验,下列推断正确的是( )| 选项 | I中试剂 | II中试剂及现象 | 推 断 |
| A | 铁粉与湿棉花 | 肥皂水冒泡 | 铁粉与水蒸气发生了反应 |
| B | 硫酸亚铁 | 品红溶液褪色 | FeSO4分解生成FeO和SO2 |
| C | 涂有石蜡油的碎瓷片 | 酸性高锰酸钾溶液褪色 | 石蜡油分解产物中含有不饱和烃 |
| D | 氯化铵 | 酚酞溶液不变红色 | 氯化铵稳定 |
| A. | A | B. | B | C. | C | D. | D |
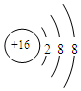 .
.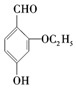 )是食品添加剂的增香原料.
)是食品添加剂的增香原料.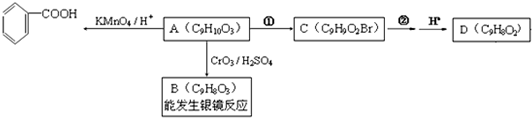
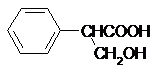 ,B
,B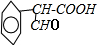 .
.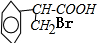 +H2O$→_{△}^{NaOH}$
+H2O$→_{△}^{NaOH}$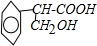 +HBr.
+HBr.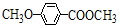 )是一种医药中间体.由茴香醛(
)是一种医药中间体.由茴香醛(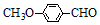 )合成E(其他原料自选),涉及的反应类型有(按反应顺序填写)氧化、酯化.
)合成E(其他原料自选),涉及的反应类型有(按反应顺序填写)氧化、酯化.