题目内容
1.28.6g Na2CO3•10H2O与足量的盐酸完全反应生成二氧化碳,反应结束后,测得溶液的总体积为100mL,试计算:(1)产生的CO2在标准状况下的体积;
(2)所得溶液中NaCl的物质的量浓度.
分析 n( Na2CO3•10H2O)=$\frac{28.6g}{286g/mol}$=0.1mol,与盐酸发生Na2CO3+2HCl=2NaCl+CO2↑+H2O,结合方程式可计算生成二氧化碳、氯化钠的体积和物质的量浓度,以此解答该题.
解答 解:n( Na2CO3•10H2O)=$\frac{28.6g}{286g/mol}$=0.1mol,与盐酸发生Na2CO3+2HCl=2NaCl+CO2↑+H2O,
(1)由方程式可知n(CO2)=n(Na2CO3)=0.1mol,则V(CO2)=0.1mol×22.4L/mol=2.24L,
答:产生的CO2在标准状况下的体积为2.24L;
(2)n(NaCl)=2n(Na2CO3)=0.2mol,则c(NaCl)=$\frac{0.2mol}{0.1L}$=2mol/L,
答:所得溶液中NaCl的物质的量浓度为2mol/L.
点评 本题考查化学方程式的计算,为高频考点,侧重考查学生的分析能力和计算能力,注意把握反应的方程式以及相关物理量的计算,难度不大.

练习册系列答案
相关题目
9.如图为实验室制取少量乙酸乙酯的装置图.下列关于该实验的叙述中,不正确的是( )
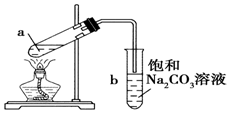

| A. | 向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加冰醋酸 | |
| B. | 试管b中导气管下端管口不能浸入液面的原因是防止实验过程中发生倒吸现象 | |
| C. | 实验时加热试管a的目的是加快反应速率并及时将乙酸乙酯蒸出 | |
| D. | 试管b中饱和Na2CO3溶液的作用是吸收随乙酸乙酯蒸出的少量乙酸和乙醇 |
16.一些治感冒的药物含有PPA成分,PPA对感冒有比较好的对症疗效,但也有较大的副作用,2000年11月,我国药监局紧急通知,停止使用含有PPA成分的感冒药,PPA是盐酸苯丙醇胺,从其名称看,其有机成份的分子结构中肯定不含下列中的( )
| A. | -OH | B. | -COOH | C. | -C 6H 5 | D. | -NH 2 |
6.紫水晶在西方国家代表着“爱的守护石”,其主要成分SiO2属于( )
| A. | 碱性氧化物 | B. | 酸性氧化物 | C. | 碱 | D. | 盐 |
13.下列化学用语表示正确的是( )
| A. | 甲烷的球棍模型: | |
| B. | 硫离子的结构示意图: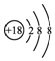 | |
| C. | HF的电子式:H:F | |
| D. | 氯酸钾的电离方程式:KClO3═K++ClO3- |
10.下列说法正确的是( )
| A. | 常温下,C(s)+H2O(g)?CO(g)+H2(g)不能自发进行,则该反应的△H<0 | |
| B. | 合成氨反应中使用高效催化剂可提高原料转化率 | |
| C. | 电解冶炼铝时需定期更换阳极的石墨电极 | |
| D. | 25℃时,向0.1 mol•L-1 CH3COOH溶液中加水稀释,$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$逐渐增大 |
11. 2015年科学家首次利用X射线现测到化学反应过渡态的形成.在固体催化剂表面“抓取”CO分子和O原子,并“配对”生 成CO2分子,下列有关说法正确的是( )
2015年科学家首次利用X射线现测到化学反应过渡态的形成.在固体催化剂表面“抓取”CO分子和O原子,并“配对”生 成CO2分子,下列有关说法正确的是( )
 2015年科学家首次利用X射线现测到化学反应过渡态的形成.在固体催化剂表面“抓取”CO分子和O原子,并“配对”生 成CO2分子,下列有关说法正确的是( )
2015年科学家首次利用X射线现测到化学反应过渡态的形成.在固体催化剂表面“抓取”CO分子和O原子,并“配对”生 成CO2分子,下列有关说法正确的是( )| A. | CO与CO2均为酸性氧化物 | |
| B. | 大量CO2的排放可导致酸雨的形成 | |
| C. | CO与O形成化学键过程中有电子转移 | |
| D. | 固体催化剂的使用会降低该反应的焓变 |
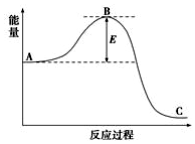 工业合成氨N2(g)+3H2(g)?2NH3(g)反应过程中的能量变化如下图所示,据图回答下列问题:
工业合成氨N2(g)+3H2(g)?2NH3(g)反应过程中的能量变化如下图所示,据图回答下列问题: