题目内容
19.硫酸铅(PbSO4)广泛应用于制造铅蓄电池、白色颜料等.利用方铅矿精矿( PbS)直接制备硫酸铅粉末的流程如图1: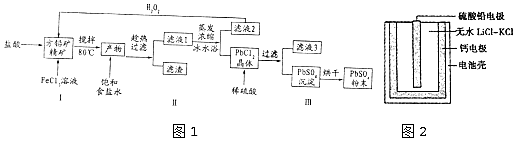
已知:(i) PbCl2 (s)+2C1-(aq)═PbCl42-(aq)△H>0
(ii)有关物质的Ksp和沉淀时的pH如表:
| 物质 | Ksp | 物质 | 开始沉淀时pH | 完全沉淀时pH |
| PbSO4 | 1.0×10-8 | Fe(OH)3 | 2.7 | 3.7 |
| PbCl2 | 1.6×10-5 | Fe(OH)2 | 6 | 7.04 |
(2)用化学平衡移动的原理解释步骤Ⅱ中使用冰水浴的原因用冰水浴使吸热反应PbCl2(s)+2Cl-(aq)?PbCl4-(aq)逆向移动,使PbCl4-不断转化为PbCl2晶体而析出.
(3)在上述生产过程中可以循环利用的物质有FeCl3和盐酸.
(4)写出步骤Ⅲ中PbCl2晶体转化为PbSO4沉淀的离子方程式PbCl2(s)+SO42-(aq)?PbSO4(s)+2Cl-(aq).
(5)PbSO4热激活电池可用作火箭、导弹的工作电源.基本结构如图2所示,其中作为电解质的无水LiCl-KC1混合物受热熔融后,电池即可瞬间输出电能.该电池总反应为PbSO4+2LiCl+Ca═CaCl2+Li2SO4+Pb.
①放电过程中,Li+向正极移动(填“负极”或“正极”).
②负极反应式为Ca+2Cl--2e-═CaCl2.
③电路中每转移0.2mol电子,理论上生成20.7g Pb.
分析 利用方铅矿精矿(PbS)直接制备硫酸铅粉末,在方铅矿精矿中加入盐酸和过量氯化铁溶液,微热80°C发生反应:PbS+2Fe3++2Cl-=PbCl2+2Fe2++S↓,发生生成PbCl2溶液,加入饱和食盐水趁热过滤,滤液蒸发浓缩,冰水浴使平衡PbCl2(s)+2Cl-(aq)?PbCl4-(aq)△H>0向着逆向移动,从而生成PbCl2晶体而析出,滤液2有氯化亚铁,加入过氧化氢生成氯化铁后循环使用,滤渣为PbCl2晶体,加入稀硫酸生成硫酸铅沉淀,过滤得到硫酸铅沉淀,烘干得到硫酸铅粉末,据此分析解答(1)~(4);
(5)根据放电时铅蓄电池工作原理为原电池,根据原电池原理,阳离子向正极移动,由及化合价变化写出负极的电极反应式,根据电极方程式进行相关计算.
解答 解:(1)步骤I反应加入盐酸后可以观察到淡黄色沉淀生成,说明生成了S单质,S元素化合价升高,则铁元素的化合价降低,反应的离子方程式为:PbS+2Fe3++2Cl-=PbCl2+2Fe2++S↓;
故答案为:PbS+2Fe3++2Cl-=PbCl2+2Fe2++S↓;
(2)加入饱和食盐水后存在化学平衡:PbCl2(s)+2Cl-(aq)?PbCl4-(aq)△H>0,在冰水浴中,温度较低,使平衡向着逆向移动,从而生成PbCl2晶体而析出;
故答案为:用冰水浴使吸热反应PbCl2(s)+2Cl-(aq)?PbCl4-(aq)逆向移动,使PbCl4-不断转化为PbCl2晶体而析出;
(3)滤液2的主要成分是FeCl2,与过氧化氢反应又生成FeCl3,反应为:2Fe2++H2O2+2H+=2Fe3++2H2O,FeCl3可循环使用,步骤Ⅲ中滤渣为PbCl2晶体,加入稀硫酸生成硫酸铅沉淀,过滤得到硫酸铅沉淀和盐酸,盐酸可循环使用;
故答案为:FeCl3和盐酸;
(4)根据题中信息可知:Ksp(PbSO4)=1.08×10-8<Ksp(PbCl2)=1.6×10-5,结合沉淀的转化,PbCl2晶体转化为PbSO4沉淀是因为PbCl2中加入稀硫酸破坏了氯化铅的溶解平衡,使溶解平衡正向移动生成硫酸铅,反应的离子方程式为:PbCl2(s)+SO42-(aq)?PbSO4 (s)+2Cl-(aq);
故答案为:PbCl2(s)+SO42-(aq)?PbSO4 (s)+2Cl-(aq);
(5)①阳离子移向正极,铅蓄电池放电过程中,Li+向正极移动;
故答案为:正极;
②负极上钙失去电子发生氧化反应,电极方程式为Ca+2Cl--2e-═CaCl2;
故答案为:Ca+2Cl--2e-═CaCl2;
③根据总反应PbSO4+2LiCl+Ca═CaCl2+Li2SO4+Pb,生成1molpb时转移2mol电子,故转移0.2mol电子时,生成0.1mol铅,质量为20.7gPb;
故答案为:20.7.
点评 本题通过物质的制备,考查了物质制备实验方案的设计方法,题目难度中等,注意掌握常见物质制备实验方案的设计方法,正确分析、理解制备流程为解答关键,试题充分考查了学生的分析、理解能力及灵活应用所学知识的能力.

| A. | 标准状况下,20mL NH3跟60mL O2所含的分子个数比为1:3 | |
| B. | 22.4L O2中一定含有6.02×1023个氧分子 | |
| C. | 将80克NaOH溶于1L水中,所得溶液的物质的量浓度为2mol/L | |
| D. | 18克H2O在标准状况下的体积为0.018L |
| A. | 150 mL 2 mol•L-1的NaCl | B. | 75 mL 2 mol•L-1的NH4Cl | ||
| C. | 150 mL 3 mol•L-1的KCl | D. | 75 mL 2 mol•L-1的CaCl2 |
| A. | 容量瓶未干燥 | |
| B. | 定容时俯视液面 | |
| C. | 转移时有液体溅出 | |
| D. | 颠倒摇匀后发现液面低于刻度线,再加水至刻度线 |
| A. | KOH和Al2(SO4)3 | B. | NaOH和Ca(HCO3)2 | C. | NaAlO2和 HCl | D. | K2CO3和HNO3 |
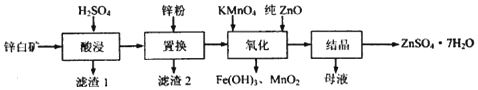
相关金属离了生成氢氧化物沉淀的pH (开始沉淀的pH按金属离子浓度为1.0mol•L-1计算)如表:
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 6.4 | 8.0 |
(2)“置换”过程中,加入适量的锌粉,除与溶液中的Fe3+,H+反应外,另一主要反应的化学方程式为Zn+CuSO4═Cu+ZnSO4.
(3)“氧化”一步中,发生反应的离子方程式为3Fe2++MnO4-+7ZnO+9H+═3Fe(OH)3+MnO2+7Zn2+.溶液PH控制在[3.2,6.4)之间的目的是使Fe3+沉淀完全,而Zn2+不沉淀MnO4-变为MnO2沉淀,避免引入杂质.
(4)“母液”中含有的盐类物质有ZnSO4、K2SO4(填化学式).
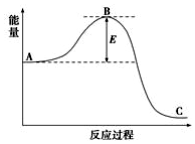 工业合成氨N2(g)+3H2(g)?2NH3(g)反应过程中的能量变化如下图所示,据图回答下列问题:
工业合成氨N2(g)+3H2(g)?2NH3(g)反应过程中的能量变化如下图所示,据图回答下列问题: