题目内容
15.等质量的D216O和H216O所含的质子数之比为9:10,中子数之比为9:8;等物质的量的D216O和H216O分别与足量的金属钠反应,放出的氢气的质量比为2:1,转移电子数之比为1:1.分析 先计算H2O和D2O的物质的量,再计算分子中质子数之比和中子数之比;
等物质的量的D2O和H2O分别与足量的金属钠反应,则有2Na~H2↑,以此来计算氢气的质量关系;
解答 解:质量相同的D2O和H2O的物质的量之比为$\frac{1}{20}$:$\frac{1}{18}$=9:10,所以质子数之比为9:10,中子数之比为9×10:10×8=9:8;
等物质的量的D2O和H2O分别与足量的金属钠反应,
由2Na~2D2O~D2↑~2e-,2Na~2H2O~H2↑~2e-,
则放出的氢气的质量比为1mol×4g/mol:1mol×2g/mol=2:1,生成氢气物质的量相等,则转移电子数相等,所以转移电子数之比为1:1;
故答案为:9:10; 8:9;2:1; 1:1;
点评 本题考查了物质的量的计算、微粒中质子数和中子数的计算,明确H、D的原子构成及Na与水的反应实质是解题关键,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
5.下列反应中,最终一定有白色沉淀生成的是( )
①向久置的Na2SO3溶液中加入BaCl2溶液,再加入稀盐酸;②向Na2CO3溶液中加入酸化的CaCl2溶液;③向Na2SO3溶液中通入Cl2,再滴入BaCl2和稀盐酸;④向Na2SO3溶液中加入稀HNO3后再加入BaCl2溶液.
①向久置的Na2SO3溶液中加入BaCl2溶液,再加入稀盐酸;②向Na2CO3溶液中加入酸化的CaCl2溶液;③向Na2SO3溶液中通入Cl2,再滴入BaCl2和稀盐酸;④向Na2SO3溶液中加入稀HNO3后再加入BaCl2溶液.
| A. | ①④ | B. | ①②③④ | C. | ③④ | D. | ①③④ |
6.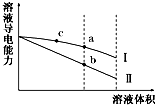 常温下,将一定浓度的盐酸和醋酸加水稀释,溶液的导电能力随溶液体积变化的曲线如图所示.判断下列说法中,正确的是( )
常温下,将一定浓度的盐酸和醋酸加水稀释,溶液的导电能力随溶液体积变化的曲线如图所示.判断下列说法中,正确的是( )
 常温下,将一定浓度的盐酸和醋酸加水稀释,溶液的导电能力随溶液体积变化的曲线如图所示.判断下列说法中,正确的是( )
常温下,将一定浓度的盐酸和醋酸加水稀释,溶液的导电能力随溶液体积变化的曲线如图所示.判断下列说法中,正确的是( )| A. | 两溶液稀释前的浓度相同 | |
| B. | a、b、c三点溶液的pH由大到小顺序为a>b>c | |
| C. | a点的KW值比b点的KW值大 | |
| D. | a点水电离的c(H+)大于c点水电离的c(H+) |
3.已知Na2SO4和NaCl混合溶液中,Cl-的物质的量浓度是Na+的物质的量浓度的0.6倍,下列叙述中正确的是( )
| A. | Na2SO4和NaCl的物质的量之比为1:3 | |
| B. | 溶液中一定有1molNa2SO4和3molNaCl | |
| C. | 所带电荷数SO42-是Na+的0.6倍 | |
| D. | SO42-与Cl-的物质的量之和等于Na+的物质的量 |
10.下列叙述中正确的是( )
| A. | 氯水、二氧化硫、活性炭的漂白或脱色原理虽然不同,但它们都能使品红或墨迹褪色 | |
| B. | 等物质的量的Cl2和SO2同时与潮湿的红布条作用,红布条立即褪色 | |
| C. | 反应CuSO4+H2S=CuS↓+H2SO4能进行,说明硫化铜既不溶于水,也不溶于稀硫酸 | |
| D. | 经Cl2和SO2漂白的物质,日后都会恢复原来的颜色 |
4.下列溶液中有关微粒的物质的量浓度关系一定正确的是( )


| A. | c(NH+4)相等的①NH4Cl②(NH4)2SO4③NH4HSO4溶液中,pH大小:①>②>③ | |
| B. | 0.1mol/LNa2S溶液:c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| C. | 25℃时,pH=2的CH3COOH与pH=12的NaOH溶液等体积混合:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| D. | 已知酸性HF>CH3COOH,pH相等的NaF与CH3COOK溶液中:[c(Na+)-c(F-)]<[c(K+)-c(CH3COO-)] |
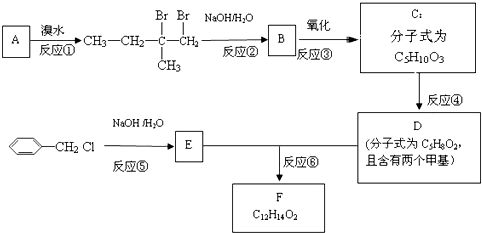
 .
.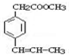 是F的一种同分异构体,属于芳香族化合物
是F的一种同分异构体,属于芳香族化合物