题目内容
4.写出用惰性电极电解下列电解质溶液的电极反应式及电解反应的化学方程式(1)Ba(OH)2:阳极:4OH--4e-═O2+2H2O;阴极:2H++2e-═H2↑,总:2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑;
(2)Na2CO3:阳极:4OH--4e-═O2+2H2O;阴极:2H++2e-═H2↑,总:2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑;
(3)KCl:阴极:2H++2e-═H2↑,阳极:2Cl--2e-═Cl2↑,总:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑;
(4)AgNO3:阴极:4Ag++4e-=4Ag;阳极:4OH--4e-═O2↑+2H2O;总:4AgNO3+2H2O$\frac{\underline{\;通电\;}}{\;}$4Ag+O2↑+4HNO3.
分析 (1)电解氢氧化钡溶液,在阳极上氢氧根离子失电子,在阴极上是氢离子得电子,据此回答;
(2)电解碳酸钠溶液,在阳极上氢氧根离子失电子,在阴极上是氢离子得电子,据此回答;
(3)电解氢氧化钠溶液,阴极发生还原反应生成氢气;电解NaCl溶液可得到氯气、氢气和氢氧化钠;
(4)用惰性电极电解硝酸银溶液时,阳极上氢氧根离子放电,阴极上银离子放电生成银.
解答 解:(1)电解氢氧化钡溶液,在阳极上氢氧根离子失电子4OH--4e-═O2+2H2O;在阴极上是氢离子得电子2H++2e-═H2↑,实质是电解水,总方程式为:$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,故答案为:阳极:4OH--4e-═O2+2H2O;阴极:2H++2e-═H2↑,总:2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑;
(2)电解碳酸钠溶液,在阳极上氢氧根离子失电子4OH--4e-═O2+2H2O;在阴极上是氢离子得电子2H++2e-═H2↑,实质是电解水,总方程式为:$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,故答案为:阳极:4OH--4e-═O2+2H2O;阴极:2H++2e-═H2↑,总:2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑;
(3)电解NaCl溶液可得到氯气、氢气和氢氧化钠,阴极发生还原反应生成氢气:2H++2e-═H2↑,阳极上是2Cl--2e-═Cl2↑,电解总方程式为2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,故答案为:阴极:2H++2e-═H2↑,阳极:2Cl--2e-═Cl2↑,总:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑;
(4)用惰性电极电解硝酸银溶液时,阳极上氢氧根离子放电,阴极上银离子放电生成银,所以阴极、阳极、电池反应式分别为4Ag++4e-=4Ag、4OH--4e-═O2+2H2O、4Ag++2H2O$\frac{\underline{\;通电\;}}{\;}$4Ag+O2+4H+,
故答案为:阴极:4Ag++4e-=4Ag;阳极:4OH--4e-═O2↑+2H2O;总:4AgNO3+2H2O$\frac{\underline{\;通电\;}}{\;}$4Ag+O2↑+4HNO3.
点评 本题以电解池为载体考查电极反应式的书写,为高频考点,明确离子放电书写是解本题关键,题目难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | 常温常压下,8gO2含有4nA个电子 | |
| B. | 标准状况下22.4 L的NH3溶于水,所得溶液中有nA个NH4+ | |
| C. | 200mL的5mol•L-1盐酸中含有nA个HCl分子 | |
| D. | 1mol Na被完全氧化生成Na2O2,失去2nA个电子 |
| A. | 除去CO2 中少量CO,通过灼热氧化铜 | |
| B. | 除去NO中少量NO2,气体通入足量水中后,用浓硫酸干燥 | |
| C. | 除去KCl固体中少量K2CO3,加入足量盐酸后,蒸发、结晶 | |
| D. | 除去CuSO4 溶液中Fe2(SO4)3 杂质,加入足量铜粉,过滤 |
| A. | 青石棉是一种硅酸盐材料 | |
| B. | 青石棉的化学组成可表示为Na2O•3FeO•Fe2O3•8SiO2•H2O | |
| C. | 1 mol青石棉中含有8 mol SiO2 | |
| D. | 1 mol青石棉能还原1 mol HNO3的稀硝酸 |
| A. | MgCO3(s)═MgO(s)+CO2(g)△H=+1.366 kJ/mol | |
| B. | MgCO3(s)═MgO(s)+CO2(g)△H=-1.366 kJ/mol | |
| C. | MgCO3(s)═MgO(s)+CO2(g)△H=-114.7 kJ/mol | |
| D. | MgCO3(s)═MgO(s)+CO2(g)△H=+114.7 kJ/mol |
| A. | Na2CO3和盐酸 | B. | AlCl3和NaOH | C. | NaAlO2和硫酸 | D. | Na2CO3和BaCl2 |
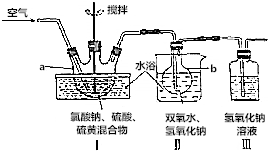
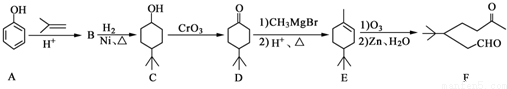
 .
. .同时满足下列条件的B的同分异构体(不包括B)共有11种:能与FeCl3溶液显紫色,苯环上只有两个取代基.
.同时满足下列条件的B的同分异构体(不包括B)共有11种:能与FeCl3溶液显紫色,苯环上只有两个取代基. (任写一种).
(任写一种).