题目内容
13.已知分解1g碳酸镁固体吸收1.366kJ,则它的热化学方程式是( )| A. | MgCO3(s)═MgO(s)+CO2(g)△H=+1.366 kJ/mol | |
| B. | MgCO3(s)═MgO(s)+CO2(g)△H=-1.366 kJ/mol | |
| C. | MgCO3(s)═MgO(s)+CO2(g)△H=-114.7 kJ/mol | |
| D. | MgCO3(s)═MgO(s)+CO2(g)△H=+114.7 kJ/mol |
分析 根据热化学方程式的书写方法可知,化学计量数与反应热成正比,并注意标明物质的聚集状态来解答.
解答 解:1g碳酸镁固体分解吸收1.366kJ的热量,则1mol碳酸镁分解吸收1.366KJ×84=114.74KJ热量,则热化学方程式为:MgCO3(s)=MgO(s)+CO2(g),△H=+114.74kJ/mol,
故选D.
点评 本题考查化学反应中的能量变化及利用盖斯定律确定反应及其能量的关系,注意键能计算焓变的方法,题目较简单,注重基础知识的考查.

练习册系列答案
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案
相关题目
20.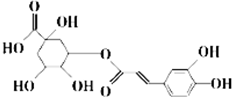 中成药银翘中含有具有较广泛抗菌作用的有效成分--绿原酸,其结构简式如图所示.下列有关说法不正确的是( )
中成药银翘中含有具有较广泛抗菌作用的有效成分--绿原酸,其结构简式如图所示.下列有关说法不正确的是( )
 中成药银翘中含有具有较广泛抗菌作用的有效成分--绿原酸,其结构简式如图所示.下列有关说法不正确的是( )
中成药银翘中含有具有较广泛抗菌作用的有效成分--绿原酸,其结构简式如图所示.下列有关说法不正确的是( )| A. | 绿原酸可通过酯化反应人工合成 | |
| B. | 1 mol绿原酸能与2molBr2发生加成反应 | |
| C. | 1mol绿原酸能与6molNa发生置换反应 | |
| D. | 绿原酸能与NaHCO3溶液发生复分解反应 |
1.用NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 常温常压下,14 g 氮气含有的原子数目为 NA | |
| B. | 0.1mol/L BaCl2溶液中Cl-数目是0.2 NA | |
| C. | 标况时,22.4L水所含水分子的数目为1NA | |
| D. | 56g铁与过量硫酸反应,需失去3NA个电子 |
8.下列酸性条件下离子能大量共存的是( )
| A. | Na+、K+、CO32-、SO42- | B. | Cu2+、SO42-、HCO3-、Na+ | ||
| C. | Cu2+、SO42-、NO3-、Fe3+ | D. | OH-、Na+、Mg2+、SO42- |
18.对处于化学平衡的体系,以化学平衡与化学反应速率的关系可知( )
| A. | 化学反应速率变化时,化学平衡一定发生移动 | |
| B. | 正反应进行的程度大、正反应速率一定大 | |
| C. | 化学平衡发生移动时、化学反应速率一定变化 | |
| D. | 只有催化剂存在下,才会发生化学反应速率变化,而化学平衡不移动的情况 |
2.下列反应的离子方程式书写正确的是( )
| A. | 钠与水的反应:Na+2H2O=Na++2OH-+H2↑ | |
| B. | 硫酸铝溶液与氨水的反应:Al3++3OH-=Al(OH)3↓ | |
| C. | 氢氧化铜与稀硫酸的反应:OH-+H+=H2O | |
| D. | 铁粉与稀盐酸反应:Fe+2H+=Fe2++H2↑ |
3.钢铁在潮湿的空气中会被腐蚀,发生的原电池反应为 2Fe+2H2O+O2═2Fe(OH)2.以下说法正确的是( )
| A. | 钢柱在水下部分比在空气与水交界处更容易腐蚀 | |
| B. | 正极发生的反应为 2H2O+O2+2e-═4OH- | |
| C. | 原电池是将电能转变为化学能的装置 | |
| D. | 负极发生的反应为 Fe-2e-═Fe2+ |