题目内容
9.亚氯酸钠(NaClO2)是一种高效漂白剂和氧化剂,受热易分解成NaClO3与NaCl.实验室制备亚氯酸钠的反应和实验装置如下: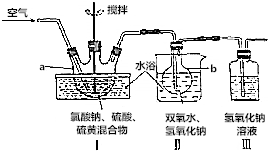
2NaClO3+SO2═2ClO2+Na2SO4
2ClO2+2NaOH+H2O2═2NaClO2+2H2O+O2
制备过程:
在仪器a中加入氯酸钠,用适量水溶解后开始搅拌,慢慢加入92.5%的硫酸,然后迅速加入硫黄,生成的ClO2气体用双氧水与氢氧化钠的混合液充分吸收即得NaClO2.
回答下列问题:
(1)仪器a的名称是三颈烧瓶
(2)水浴加热的优点有受热均匀,便于控制加热温度.
(3)装置Ⅱ中用双氧水与氢氧化钠的混合液吸收ClO2时,双氧水作还原剂.
(4)装置Ⅲ中反应的离子方程式为SO2+2OH-=SO32-+H2O.
(5)反应后的混合液中ClO2-的浓度可用碘量法进行测定.其反应原理如下:在酸性条件下ClO2-能被I-完全还愿为Cl-反应生成的I2用标准Na2S2O3溶液滴定(化学方程式为2Na2S2O3+I2═Na2S4O6+2NaI).
实验步骤:取25.00ml反应后的混合液于500ml容量瓶中,加水至刻度线,摇匀.然后从其中取25.00ml于锥形瓶中,加入适量硫酸、足量的KI晶体,再滴加少量指示剂,用0.5000mol•L-1的Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液16.00ml.
①滴定选用的指示剂为淀粉溶液,滴定终点观察到的现象为滴入最后一滴Na2S2O3标准液,终点溶液由蓝色变为无色且半分钟内不变色,.
②根据上述数据分析,原混合液中ClO2-的浓度为1.6mol•L-1.
分析 (1)由图可知,仪器a是三颈烧瓶;
(2)水浴加热避免了直造成的过度剧烈与温度的不可控性,可以平稳地加热;
(3)在2ClO2+2NaOH+H2O2═2NaClO2+2H2O+O2中,H2O2中O由-1变为0价,化合价升高,作还原剂;
(4)装置Ⅲ中氢氧化钠溶液用于未吸收完全的二氧化硫气体;
(5)①碘遇淀粉变蓝,因此可选用淀粉溶液作指示剂;该反应是Na2S2O3标准液滴定碘,终点溶液由蓝色变为无色且半分钟内不变色;
②ClO2-+4I-+4H+═2H2O+2I2+Cl-和I2+2S2O32-═2I-+S4O62-找出关系式ClO2-~2I2~4S2O32-进行计算.
解答 解:(1)由图可知,仪器a是三颈烧瓶,
故答案为:三颈烧瓶;
(2)水浴加热避免了直造成的过度剧烈与温度的不可控性,可以平稳地加热,因此水浴加热受热均匀,便于控制加热温度,
故答案为:受热均匀,便于控制加热温度;
(3)在2ClO2+2NaOH+H2O2═2NaClO2+2H2O+O2中,H2O2中O由-1变为0价,化合价升高,作还原剂,
故答案为:还原;
(4)装置Ⅲ中氢氧化钠溶液用于未吸收完全的二氧化硫气体,离子方程式为SO2+2OH-=SO32-+H2O,
故答案为:SO2+2OH-=SO32-+H2O;
(5)①有碘单质参和生成的反应,一般采用淀粉溶液做指示剂,该反应是Na2S2O3标准液滴定碘,滴入最后一滴Na2S2O3标准液,终点溶液由蓝色变为无色且半分钟内不变色,
故答案为:淀粉溶液;滴入最后一滴Na2S2O3标准液,终点溶液由蓝色变为无色且半分钟内不变色;
②16.00mlNa2S2O3溶液含有S2O32-的物质的量为0.5000mol•L-1×0.016L=0.008mol,由ClO2-~2I2~4S2O32-可知反应后的混合液25.00ml溶液中含有ClO2-的物质的量为0.008mol×$\frac{1}{4}$×$\frac{500ml}{25ml}$=0.04mol,则原混合液中ClO2-的浓度为$\frac{0.04mol}{0.025L}$=1.6mol•L-1,
故答案为:1.6.
点评 本题主要考查物质的制备、实验的原理、氧化还原反应滴定等,理解原理是解题的关键,同时考查学生分析问题、解决问题的能力,注意氧化还原反应滴定中利用关系式进行的计算,难度较大.

| A. | 液氨常被用作制冷剂 | |
| B. | 可利用2Fe3++Cu═Cu2++2Fe2+腐蚀印刷电路板 | |
| C. | 为便于储存和使用,可用液氯代替氯水漂白干燥棉布上的有色物质为便于储存和使用,可用液氯代替氯水漂白干燥棉布上的有色物质 | |
| D. | 已知3Cl2+2NH3═N2+6HCl,工业上可用浓氨水检查氯气管道是否漏气 |
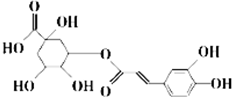 中成药银翘中含有具有较广泛抗菌作用的有效成分--绿原酸,其结构简式如图所示.下列有关说法不正确的是( )
中成药银翘中含有具有较广泛抗菌作用的有效成分--绿原酸,其结构简式如图所示.下列有关说法不正确的是( )| A. | 绿原酸可通过酯化反应人工合成 | |
| B. | 1 mol绿原酸能与2molBr2发生加成反应 | |
| C. | 1mol绿原酸能与6molNa发生置换反应 | |
| D. | 绿原酸能与NaHCO3溶液发生复分解反应 |
| A. | υ(A)=0.5 mol/(L•min) | B. | υ(B)=0.3 mol/(L•min) | ||
| C. | υ(C)=0.03 mol/(L•s) | D. | υ(D)=1 mol/(L•min) |
| A. | CO2 | B. | NH3 | C. | Cl2 | D. | NO2 |
| A. | 常温常压下,14 g 氮气含有的原子数目为 NA | |
| B. | 0.1mol/L BaCl2溶液中Cl-数目是0.2 NA | |
| C. | 标况时,22.4L水所含水分子的数目为1NA | |
| D. | 56g铁与过量硫酸反应,需失去3NA个电子 |
| A. | 钠与水的反应:Na+2H2O=Na++2OH-+H2↑ | |
| B. | 硫酸铝溶液与氨水的反应:Al3++3OH-=Al(OH)3↓ | |
| C. | 氢氧化铜与稀硫酸的反应:OH-+H+=H2O | |
| D. | 铁粉与稀盐酸反应:Fe+2H+=Fe2++H2↑ |
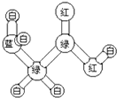 有机物A是构成营养素的基础物质,A的球棍模型如图所示,图中“棍”代表单键或双键或三键,不同颜色的球代表不同元素的原子.回答下列问题:
有机物A是构成营养素的基础物质,A的球棍模型如图所示,图中“棍”代表单键或双键或三键,不同颜色的球代表不同元素的原子.回答下列问题: