题目内容
11.下列说法正确的是( )| A. | 某溶液中滴入AgNO3溶液,产生白色沉淀,该溶液中一定含Cl- | |
| B. | 某溶液与淀粉碘化钾溶液反应后显蓝色,证明溶液是氯水或溴水 | |
| C. | 将氟气通入氯化钠水溶液中,一定有氢氟酸和O2生成 | |
| D. | 实验证明氯水也能导电,所以氯水是电解质 |
分析 A.该白色沉淀可能为碳酸银,原溶液中可能含有碳酸根离子;
B.只能证明该溶液具有氧化性,可能为双氧水;
C.氟气化学性质比较活泼,能够与水反应生成氟化氢和氧气;
D.氯水为混合物,不是电解质和非电解质.
解答 解:A.某溶液中滴入AgNO3溶液,产生白色沉淀,该沉淀可能为碳酸银,溶液中可能含有碳酸根离子,不一定含Cl-,故A错误;
B.某溶液与淀粉碘化钾溶液反应后显蓝色,说明该溶液具有氧化性,可能为双氧水或硝酸,不一定是氯水或溴水,故B错误;
C.将氟气通入氯化钠水溶液中,氟气首先与水反应,所以一定有氢氟酸和O2生成,故C正确;
D.氯水也能导电,但是氯水是混合物,而电解质必须为化合物,故D错误;
故选C.
点评 本题考查了化学实验方案的评价,题目难度不大,涉及离子检验、氟气的化学性质、电解质与非电解质的判断等知识,明确常见元素及其化合物性质为解答关键,试题培养了学生的灵活应用能力.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案
相关题目
20.下列实验操作、现象和结论均正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 分别加热Na2CO3和NaHCO3固体 | 试管内壁均有水珠 | 两种物质均受热分解 |
| B | 加热盛有NH4Cl固体的试管 | 试管底部固体消失,试管口有晶体凝结 | NH4Cl固体可以升华 |
| C | 向NaBr溶液中滴入少量氯水和苯,振荡、静置 | 溶液上层呈橙红色 | Br-还原性强于Cl- |
| D | 向FeSO4溶液中先滴入KSCN溶液,再滴加H2O2溶液 | 加入H2O2后溶液变成血红色 | Fe2+既有氧化性又有还原性 |
| A. | A | B. | B | C. | C | D. | D |
2.白钨矿的主要成分是钨酸钙(CaWO4),其中钨的化合价为( )
| A. | +3 | B. | +4 | C. | +6 | D. | +7 |
19.下列物质不能破坏水的电离平衡的是( )
| A. | NaCl | B. | H2S | C. | Na2S | D. | NH4Cl |
6.双酚A是食品、饮料包装和奶瓶等塑料制品的添加剂,能导致人体内分泌失调,对儿童的健康危害更大.下列有关双酚A的叙述不正确的是( )
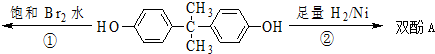

| A. | 双酚A的分子式是C15H16O2 | |
| B. | 双酚A的核磁共振氢谱显示氢原子数之比是1:2:2:3 | |
| C. | 反应①中,1 mol双酚A最多消耗4mol Br2 | |
| D. | 反应②的产物中有两种官能团 |
16.制烧碱所用盐水需两次精制.第一次精制主要是用沉淀法除去粗盐水中ca2+、Mg2+、Fe3+、SO42-等离子,过程如下:
I.向粗盐水中加入过量BaCl2溶液,过滤;
II.向所得滤液中加入过量Na2C03溶液,过滤;
III.滤液用盐酸调节pH,获得一次精制盐水.
(1)过程I、II生成的部分沉淀及其溶解度(20°C/g)如下表:
①检测Fe3+是否除尽的方法是取少量过程II后的滤液于试管中,滴加几滴KSCN溶液,若溶液不变红,说明Fe3+已除尽,反之没除尽.
②过程I选用BaCl2而不选用CaCl2,运用表中数据解释原因BaSO4的溶解度比CaSO4的小,可将SO42-沉淀更完.
③除去Mg2+的离子方程式是2Mg2++2CO32-+H2O═Mg2(OH)2CO3↓+CO2↑.
④检测ca2+、Mg2+、B2+是否除尽时,只需检测Ba2+(填离子符号).
(2)第二次精制要除去微量的Iˉ、IO3ˉ、NH4+、Ca2+、Mg2+,流程示意如下: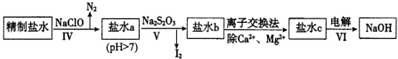
①过程IV除去的离子是NH4+、I-.
②盐水b中含有SO42-.Na2S203将IO3-还原为12的离子方程式是5S2O32-+8IO3-+2OH-═4I2+10SO42-+H2O.
③过程VI中,在电解槽的阴极区生成NaOH,结合化学平衡原理解释:H+在阴极上得电子变成H2逸出,使H2O?H++OH-电离平衡向右移动,OH-在阴极区浓度增大,Na+向阴极区移动,最后NaOH在阴极区生成.
I.向粗盐水中加入过量BaCl2溶液,过滤;
II.向所得滤液中加入过量Na2C03溶液,过滤;
III.滤液用盐酸调节pH,获得一次精制盐水.
(1)过程I、II生成的部分沉淀及其溶解度(20°C/g)如下表:
| CaS04 | Mg2(OH)2C03 | CaC03 | BaS04 | BaC03 |
| 2.6×1 0-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×1 0-3 |
②过程I选用BaCl2而不选用CaCl2,运用表中数据解释原因BaSO4的溶解度比CaSO4的小,可将SO42-沉淀更完.
③除去Mg2+的离子方程式是2Mg2++2CO32-+H2O═Mg2(OH)2CO3↓+CO2↑.
④检测ca2+、Mg2+、B2+是否除尽时,只需检测Ba2+(填离子符号).
(2)第二次精制要除去微量的Iˉ、IO3ˉ、NH4+、Ca2+、Mg2+,流程示意如下:

①过程IV除去的离子是NH4+、I-.
②盐水b中含有SO42-.Na2S203将IO3-还原为12的离子方程式是5S2O32-+8IO3-+2OH-═4I2+10SO42-+H2O.
③过程VI中,在电解槽的阴极区生成NaOH,结合化学平衡原理解释:H+在阴极上得电子变成H2逸出,使H2O?H++OH-电离平衡向右移动,OH-在阴极区浓度增大,Na+向阴极区移动,最后NaOH在阴极区生成.
20.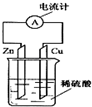 如图所示,把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池.下列叙述正确的是( )
如图所示,把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池.下列叙述正确的是( )
 如图所示,把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池.下列叙述正确的是( )
如图所示,把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池.下列叙述正确的是( )| A. | 该装置将电能转变为化学能 | B. | 电流从锌片经导线流向铜片 | ||
| C. | 一段时间后,铜片质量减轻 | D. | 锌片上发生氧化反应 |
1.纯水中存在如下平衡:H2O?H++OH-△H>0,当改变条件时,填写表中各项内容.
| 改变条件 | 平衡移动方向 | pH | 水电离出的c(H+) | KW |
| 升温 | ||||
| 通入HCl气体 | ||||
| 加入NaOH固体 | ||||
| 加入NH4Cl固体 | ||||
| 加入金属钠 |