题目内容
3.pH相等且等体积的醋酸和盐酸与足量的Zn反应,产生H2起始速率醋酸=盐酸(填>,<或=),整个反应过程产生H2的平均反应速率醋酸>盐酸(填>,<或=),放出的H2醋酸>盐酸(填>,<或=);物质的量浓度相等,且等体积的醋酸和盐酸与足量的Zn反应,产生H2起始速率醋酸<盐酸,放出H2的物质的量醋酸=盐酸.分析 醋酸为弱酸,pH相等时,醋酸浓度较大,开始反应时由于氢离子浓度相等,则反应速率相等,但随着反应的进行,醋酸进一步电离;等浓度时,盐酸中氢离子浓度较大,以此解答该题.
解答 解:醋酸为弱酸,pH相等时,醋酸浓度较大,开始反应时由于氢离子浓度相等,则反应速率相等,但随着反应的进行,醋酸进一步电离,醋酸中氢离子浓度较大,反应速率较大,由于醋酸的物质的量浓度较大,则等体积时放出的氢气较多;等浓度时,盐酸中氢离子浓度较大,开始反应时生成氢气速率较大,完全反应时二者生成的氢气的物质的量相等,
故答案为:=;>;>;<;=.
点评 本题考查了弱电解质的电离及其影响,为高频考点,题目难度中等,明确弱电解质的电离特点为解答关键,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
14.比较乙烷、乙烯、乙炔的组成、结构和性质,不正确的叙述是( )
| A. | 这三种物质都属于气态烃 | |
| B. | 乙炔中碳的质量分数最小 | |
| C. | 溴水能与乙烯和乙炔加成,但不能与乙烷反应 | |
| D. | 一个分子中,共用电子对最多的物质是乙烷 |
11.下列说法正确的是( )
| A. | 某溶液中滴入AgNO3溶液,产生白色沉淀,该溶液中一定含Cl- | |
| B. | 某溶液与淀粉碘化钾溶液反应后显蓝色,证明溶液是氯水或溴水 | |
| C. | 将氟气通入氯化钠水溶液中,一定有氢氟酸和O2生成 | |
| D. | 实验证明氯水也能导电,所以氯水是电解质 |
15.下列化学用语的表述正确的是( )
| A. | CSO的电子式: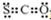 | B. | NaClO的电子式: | ||
| C. | CO2的分子示意图: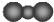 | D. | 次氯酸的结构式:H-Cl-O |
12.用NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 1 mol OH-中含有9NA个电子 | |
| B. | 28 g CO气体中含有NA个氧原子 | |
| C. | 1 mol/L AlCl3溶液中含有NA个Al3+ | |
| D. | 常温常压下,11.2 L甲烷气体中含有的分子数为0.5NA |

 .
.