题目内容
20.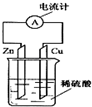 如图所示,把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池.下列叙述正确的是( )
如图所示,把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池.下列叙述正确的是( )| A. | 该装置将电能转变为化学能 | B. | 电流从锌片经导线流向铜片 | ||
| C. | 一段时间后,铜片质量减轻 | D. | 锌片上发生氧化反应 |
分析 该装置能自发的进行氧化还原反应,所以能构成原电池,锌易失电子发生氧化反应而作负极,铜作正极,电子从负极沿导线流向正极,电流流向与此相反,据此分析解答.
解答 解:A.该装置是将化学能转化为电能的装置,属于原电池,故A错误;
B.该装置中,锌易失电子作负极,铜作正极,电流从正极铜沿导线流向负极锌,故B错误;
C.铜作正极,正极上氢离子得电子生成氢气,所以铜片质量不变,故C错误;
D.该装置中,锌失电子发生氧化反应,故D正确;
故选D.
点评 本题考查了原电池原理,明确原电池的判断方法、正负极的判断、正负极上发生的反应即可解答,难度不大.

练习册系列答案
相关题目
11.下列说法正确的是( )
| A. | 某溶液中滴入AgNO3溶液,产生白色沉淀,该溶液中一定含Cl- | |
| B. | 某溶液与淀粉碘化钾溶液反应后显蓝色,证明溶液是氯水或溴水 | |
| C. | 将氟气通入氯化钠水溶液中,一定有氢氟酸和O2生成 | |
| D. | 实验证明氯水也能导电,所以氯水是电解质 |
15.下列化学用语的表述正确的是( )
| A. | CSO的电子式: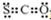 | B. | NaClO的电子式: | ||
| C. | CO2的分子示意图: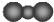 | D. | 次氯酸的结构式:H-Cl-O |
9.下列叙述中不正确的是( )
| A. | 一定浓度的醋酸钠溶液可使酚酞溶液变红,其原因是发生了如下反应:CH3COO-+H2O?CH3COOH+OH-,使得溶液中的c(OH-)>c(H+) | |
| B. | 在常温下,10 mL 0.2 molL-1盐酸与10 mL 0.2 molL-1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=13 | |
| C. | 在0.1 molL-1 NH4Cl溶液中:c(H+)+c(NH4+)=c(Cl-) | |
| D. | 5 mL 1 molL-1 CH3COONa溶液与5 mL 1 molL-1盐酸混合液中c(Cl-)=c(Na+)>c(H+)>c(OH-) |
9.某100ml溶液中含H2SO40.50mol,加入下列物质,溶液导电性增强的是( )
| A. | 0.50 mol Ba(OH)2 | B. | 100 mL水 | C. | 0.50molC2H5OH | D. | 0.50molNa2SO4 |
 .
.